下列实验设计方案中,可行的是
| A.用碱石灰除去氯气中的水 |
| B.在某试样中加入NaOH溶液加热,产生能使蓝色石蕊试纸变红的气体即证明有NH4+ |
| C.焰色反应实验中用硫酸清洗铁丝,灼烧后再沾取试样在酒精灯上灼烧观察[ |
| D.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
下列解释实验事实的离子方程式不正确的是()
| A.用烧碱溶液吸收NO2:2NO2+2OH-=NO3-+ NO2-+ H2O |
| B.用烧碱溶液吸收氯气:Cl2+2OH-=Cl-+ClO-+H2O |
| C.明矾溶液与过量氨水反应:Al3+ +3NH3.H2O=Al(OH)3↓ + 3NH4+ |
| D.酸性KI淀粉溶液久置后变蓝:4I-+O2+2H2O=2I2+4OH- |
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是()
| 选项 |
陈述Ⅰ |
陈述Ⅱ |
| A |
氧化性:Fe3+>Cu2+ |
还原性:Fe2+>Cu |
| B |
纯银器表面在空气中渐渐变暗 |
Ag发生了化学腐蚀 |
| C |
SiO2能与氢氟酸及碱反应 |
SiO2是两性氧化物 |
| D |
BaSO4饱和溶液中加入饱和Na2CO3溶液有白色沉淀 |
说明Ksp(BaSO4)大于Ksp(BaCO3) |
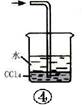
如图各装置不能达到实验目的的是()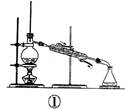
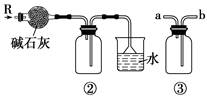
| A.装置①可用于由工业酒精制取无水酒精 | B.装置②可用于干燥、收集氨气,并吸收多余的氨气 |
| C.装置③可用于排空气法收集NO气体 | D.装置④中下层物质若为四氯化碳,则可用于吸收氯化氢 |
设NA代表阿伏加德罗常数的数值,下列说法中不正确的是()
| A.常温常压下,20 g重甲基(-14CD3)所含的中子数为11NA; |
| B.常温常压下,22.4 L NO气体的分子数小于NA; |
| C.64 g铜发生氧化还原反应,一定失去2NA个电子; |
| D.室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA; |
下列各组离子,在pH=0的溶液中可以大量共存的是()
| A.Al3+、Fe3+、Br—、SO42— |
| B.K+、Ca2+、SO42—、Cl— |
| C.Na+、Cu2+、I—、NO3— |
| D.NH4+、K+、HPO42—、Cl— |