下列解释实验事实的离子方程式不正确的是( )
| A.用烧碱溶液吸收NO2:2NO2+2OH-=NO3-+ NO2-+ H2O |
| B.用烧碱溶液吸收氯气:Cl2+2OH-=Cl-+ClO-+H2O |
| C.明矾溶液与过量氨水反应:Al3+ +3NH3.H2O=Al(OH)3↓ + 3NH4+ |
| D.酸性KI淀粉溶液久置后变蓝:4I-+O2+2H2O=2I2+4OH- |
下列有关化学反应表达正确的是
A.甲醛溶液与足量的银氨溶液共热:HCHO+4[Ag(NH3)2]++4OH- CO32-+2NH4++4Ag↓+6NH3+2H2O CO32-+2NH4++4Ag↓+6NH3+2H2O |
B.服用阿司匹林过量出现水杨酸( )中毒反应,可静脉注射NaHCO3溶液: )中毒反应,可静脉注射NaHCO3溶液: + 2 HCO3- → + 2 HCO3- → + 2 CO2↑ + 2 H2O + 2 CO2↑ + 2 H2O |
C.向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH- CH2BrCOO-+H2O CH2BrCOO-+H2O |
| D.苯酚钠溶液中通入少量CO2: CO2+H2O+2C6H5O- → 2C6H5OH+2CO32- |
我国支持“人文奥运”,坚决反对运动员服用兴奋剂。某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是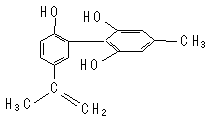
| A.遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 |
| B.滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键 |
| C.该分子中的所有原子有可能共平面 |
| D.1 mol该物质与浓溴水和H2反应最多消耗Br2和H2分别为4 mol、7 mol |
下列实验处理不可行的是
①将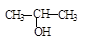 与NaOH的醇溶液共热制备CH3—CH═CH2
与NaOH的醇溶液共热制备CH3—CH═CH2
②向甲酸和甲醛的混合物中加入氢氧化钠溶液,中和甲酸后,加入新制的氢氧化铜加热,检验混合物中是否含有甲醛
③向丙烯醛(CH2=CH—CHO)中滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键
④为验证某RX是碘代烷,把RX与烧碱水溶液混合加热后,将溶液冷却后再滴入几滴硝酸银溶液,观察现象
⑤淀粉在硫酸催化作用下水解,将银氨溶液加入到水解后的溶液中可检验淀粉水解的产物葡萄糖
| A.只有①③⑤ | B.只有①②④ | C.只有②③④ | D.都不能 |
下列每组中各有三对物质,它们都能用分液漏斗分离的是
| A.乙酸乙酯和水,酒精和水,植物油和水 |
| B.四氯化碳和水,溴苯和水,硝基苯和水 |
| C.甘油和水,乙酸和水,乙酸和乙醇 |
| D.汽油和水,苯和甲苯,己烷和水 |
下列化合物中,既能发生消去反应生成烯烃,又能发生水解反应的是