以下是对某溶液进行离子检验的方法和结论,其中正确的是
| A.先加入BaCl2溶液,再加入HNO3溶液,产生了白色沉淀,则溶液中一定含有大量的SO42- |
| B.加入足量的CaCl2溶液,产生了白色沉淀,则溶液中一定含有大量的CO32- |
| C.加入盐酸,能产生使澄清石灰水变浑浊的气体,则溶液中一定含有CO32- |
| D.先加适量的硝酸将溶液酸化,再加入AgNO3溶液,产生了白色沉淀,则溶液中一定含大量的Cl- |
在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应
X(g)+Y(g)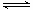 2Z(g) △H < 0, 一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H < 0, 一段时间后达到平衡,反应过程中测定的数据如下表:
| t/min |
2 |
4 |
7 |
9 |
| n(Y)/mol |
0.12 |
0.11 |
0.10 |
0.10 |
下列说法正确的是
A.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)> ν(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2 转变为H2、CO。其过程如下:
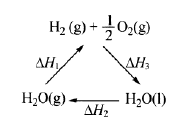
下列说法不正确的是
| A.该过程中CeO2没有消耗 |
| B.该过程实现了太阳能向化学能的转化 |
| C.右图中△H1=△H2+△H3 |
| D.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH——2e—=CO32—+2H2O |
部分弱酸的电离平衡常数如下表:
| 弱酸 |
HCOOH |
HCN |
H2CO3 |
| 电离平衡常数 (25℃) |
Ki=1.77×10-4 |
Ki=4.9×10-10 |
Ki1=4.3×10-7 Ki2=5.6×10-11 |
下列选项错误的是
A.2CN-+H2O+CO2→2HCN+CO32-
B.2HCOOH+CO32-→2HCOO-+H2O+CO2↑
C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者
某恒温密闭容器中,可逆反应A(s)  B+C(g) △H=" +" QkL/mol(Q>0)达到平衡。缩小容器体积,重新达到平衡,C的浓度比原平衡的浓度大。以下分析正确的是
B+C(g) △H=" +" QkL/mol(Q>0)达到平衡。缩小容器体积,重新达到平衡,C的浓度比原平衡的浓度大。以下分析正确的是
A.产物B的状态只能为固态或液态
B.平衡时,单位时间内n(A)消耗﹕n(C)消耗=1﹕1
C.保持体积不变,向平衡体系中加入B,平衡不可能向逆反应方向移动
D.若开始时向容器中加入1molB和1molC,达到平衡时放出热量QkJ
下列有关说法正确的是
| A.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H>0 |
| B.电解法精炼铜时,以粗铜作阴极,纯铜作阳极 |
C.CH3COOH 溶液加水稀释后,溶液中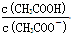 的值减小 的值减小 |
| D.Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH 减小 |