一定条件下,体积为10L的密闭容器中,1molX和1molY进行反应:
2X(g)+Y(g) Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是( )
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是( )
| A.以X浓度变化表示的反应速率为0.001mol/(L·S) |
B.将容器体积变为20L,Z的平衡浓度变为原来的 |
| C.若增大压强,则物质Y的转化率减小 |
| D.若升高温度,X的体积分数增大,则该反应的△H>0 |
下列离子方程式书写正确的是()
| A.硫酸铜溶液中加入过量Ba(OH)2溶液:Ba2++SO42-=BaSO4↓ | |
B.A1Cl3溶液中加过量的NaOH溶液:Al 3++3OH-=Al(OH)3↓ 3++3OH-=Al(OH)3↓ |
|
C.铜与硝酸银溶液反应:Cu+Ag+=Cu2++Ag |
D.碳酸钙与过量盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O |
在2A+B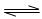 3C+4D反应中,相同条件下表示该反应速率最快的是()
3C+4D反应中,相同条件下表示该反应速率最快的是()
A.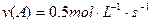 |
B.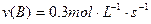 |
C.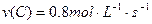 |
D.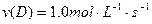 |
下列各组离子在水溶液中能大量共存的是()
| A.Na+、NH4+、:HCO3一、OH- |
| B.Fe3+、Zn2+、I-、SO42- |
| C.H+、K+、NO3-、SO42一 |
| D.Ca2+、Na+、NO3-、CO32- |
某学生的实验报告所列出的下列数据,合理的是()
| A.用200 mL量筒量取7.1 mL稀盐酸 |
| B.用酸式滴定管量取某稀硫酸20.40 mL |
| C.用广泛pH试纸测得某溶液的pH为11.3 |
| D.用托盘天平精确称量某碳酸钠样品8.32 g |
在100 mL0.01 mol·L-1KCl溶液中,加入1 mL0.01 mol·L—1AgNO3溶液,下列说法正确的是(已知AgCl Ksp=1.8×10-10)()
A.有沉淀但不是AgCl B.无AgCl沉淀
c.有AgCl沉淀析出 D.无法确定