有一固体混合物可能含有氯化铁、亚硝酸钠、硝酸银、氯化铜、硝酸钠、熟石灰和氯化铵等7种物质。将混合物溶于水得白色沉淀和无色溶液。白色沉淀可溶于氨水中。无色溶液与强碱共热放出的气体可使酚酞变红。无色溶液也可使酸性高锰酸钾溶液褪色。无色溶液受热时可放出氮气。
已知:Ksp(AgNO2)=6.0×10-4;Ksp(AgCl)=1.56×10-10
回答下列问题(用化学符号回答):
(1)该固体混合物中肯定存在的物质是________________,肯定不存在的物质是_______________。
(2)混合物溶于水时所得的白色沉淀中肯定有________________。该沉淀溶于氨水的离子方程式为_______________________________________。
(3)无色溶液中,使酸性高锰酸钾褪色的物质是___________________。
(4)写出无色溶液受热时放出氮气的化学方程式__________________。
等电子体原理的应用
⑴与OH-互为等电子体的一种分子为(填化学式);
⑵S于O可形成SO42-,
①SO42-的空间构型为(用文字描述);
②写出一种鱼SO42-互为等电子体的分子的化学式。
⑶BF4-的立体构型为。
可逆反应:aA(g)+ bB(g) cC(g)+ dD(g);根据图回答:
cC(g)+ dD(g);根据图回答: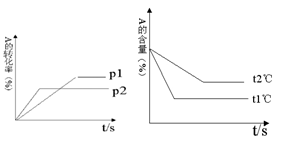
(1)压强 P1比P2(填大或小); (2)(a +b)比(c +d)(填大或小);
(3)温度t1℃比t2℃(填高或低);(4)正反应为反应。
7分)将标准状况下4.48 L的CO2通入适量的NaOH溶液中充分反应后,溶液中生成盐的质量为19.0 g。
(1)若要使生成的盐的质量变为25.2 g,则应继续向溶液中通入CO2多少克?(写出计算过程)
(2)向生成的19.0 g的盐溶液中加入一定量某物质,充分反应后,减压低温蒸发得到纯净的21.2 g Na2CO3固体。则:
①若只能加入0.05 mol某物质,则加入的物质可以是________或________。
②若只能加入0.10 mol某物质,则加入的物质可以是________或________。
硝酸是一种重要的工业原料,工业制硝酸的关键是氨的催化氧化,与硝酸工业相关的过程中产生的氮氧化物的处理与应用也是科学研究的热点。
I.图1、图2分别是实验室模拟合成氨及氨催化氧化的装置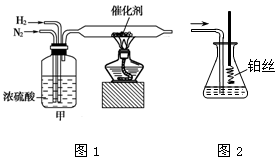
(1)氮气和氢气通过图1装置,该装置中浓硫酸的作用是控制气体流速和。
(2)用图2装置吸收一段时间氨后,再通入空气,同时将已经加热的铂丝插入乙装置的锥形瓶内,铂丝保持红热的原因是,写出该装置中氨氧化的化学方程式。反应结束后锥形瓶内的溶液中含有H+、OH-、离子、离子。
II.下列有关硝酸事实的解释合理的是
| A.浓硝酸通常保存在棕色的试剂瓶中,说明浓硝酸不稳定 |
| B.足量铁与稀硝酸反应后溶液呈浅绿色,说明稀硝酸不能氧化亚铁离子 |
| C.不用浓硝酸与铜屑反应来制取硝酸铜,说明浓硝酸具有挥发性 |
| D.不用锌与稀硝酸反应制取氢气,说明稀硝酸能将锌钝化工业生产硝酸的尾气中含有氮氧化物NOx(NO和NO2的混合物,假设不含N2O4),对生态环境和人类健康带来较大的威胁。 |
(1)工业上常用Na2CO3溶液吸收法处理NOx 。
已知:NO不能与Na2CO3溶液反应
NO + NO2 + Na2CO3 = 2NaNO2 + CO2①
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2②
用足量的Na2CO3溶液完全吸收NOx,每产生5.6L(标准状况)CO2(全部逸出)时,吸收液质量就增加10g,则NOx中的x值为。
(2)尿素也可用于吸收处理NOx,其反应原理为:
NO+NO2+H2O=2HNO2
2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。
当混合气体中NO、NO2按上述反应中系数比时吸收效果最佳。若混合气体中V(NO)∶V(NO2)=3∶1时,可通入一定量的空气,同温同压下,V(空气)∶V(NO)=(空气中氧气的体积含量约为20%)。
绿矾(FeSO4·7H2O)硫酸法生产一种稀有金属产品过程中产出的副产品,产品外观为淡绿色或淡黄绿色结晶固体。加入适量可调节碱性水中的pH,与水中悬浮物有机结合,并加速沉淀,主要应用于水质净化和工业废水处理,同时具有杀菌作用。
(1)98% 1.84 g/cm3的浓硫酸在稀释过程中,密度下降,当稀释至50%时,密度为1.4g/cm3,50%的硫酸物质的量浓度为(保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的浓度为(填>、<、=")40%" 。
(2)实际生产用20%发烟硫酸(100克发烟硫酸含SO3 20克)配制稀硫酸,若用SO3·nH2O表示20%的发烟硫酸,则n=____________(保留两位小数)。
(3)绿矾在空气中容易被部分氧化为硫酸铁,现取7.32克晶体溶于稀盐酸后,加入足量的BaCl2溶液,过滤得沉淀9.32克;再通入112mL(标准状况)氯气恰好将Fe2+完全氧化,推测晶体的化学式为。
(4)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在分析化学中常用来配制Fe2+的标准溶液,用此Fe2+的标准溶液可以测定剩余稀硝酸的量。现取8.64克Cu2S和CuS的混合物用200 mL 2 mol/L稀硝酸溶液处理,发生反应如下:
10NO3-+3Cu2S+16H+=6Cu2++10NO↑+3SO42-+8H2O
8NO3-+3CuS+8H+=3Cu2++3 SO42-+8NO↑+ 4H2O
剩余的稀硝酸恰好与V mL 2 mol/L (NH4)2Fe(SO4)2溶液完全反应。
已知:NO3-+3Fe2++4H+= NO↑+3Fe3++2H2O
①V值范围;
②若V=48,试计算混合物中CuS的质量分数(保留两位小数)。