硝酸是一种重要的工业原料,工业制硝酸的关键是氨的催化氧化,与硝酸工业相关的过程中产生的氮氧化物的处理与应用也是科学研究的热点。
I.图1、图2分别是实验室模拟合成氨及氨催化氧化的装置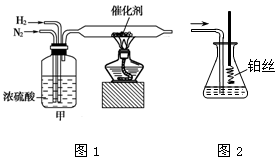
(1)氮气和氢气通过图1装置,该装置中浓硫酸的作用是控制气体流速和 。
(2)用图2装置吸收一段时间氨后,再通入空气,同时将已经加热的铂丝插入乙装置的锥形瓶内,铂丝保持红热的原因是 ,写出该装置中氨氧化的化学方程式 。反应结束后锥形瓶内的溶液中含有H+、OH-、 离子、 离子。
II.下列有关硝酸事实的解释合理的是
| A.浓硝酸通常保存在棕色的试剂瓶中,说明浓硝酸不稳定 |
| B.足量铁与稀硝酸反应后溶液呈浅绿色,说明稀硝酸不能氧化亚铁离子 |
| C.不用浓硝酸与铜屑反应来制取硝酸铜,说明浓硝酸具有挥发性 |
| D.不用锌与稀硝酸反应制取氢气,说明稀硝酸能将锌钝化工业生产硝酸的尾气中含有氮氧化物NOx(NO和NO2的混合物,假设不含N2O4),对生态环境和人类健康带来较大的威胁。 |
(1)工业上常用Na2CO3溶液吸收法处理NOx 。
已知:NO不能与Na2CO3溶液反应
NO + NO2 + Na2CO3 = 2NaNO2 + CO2 ①
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2 ②
用足量的Na2CO3溶液完全吸收NOx,每产生5.6L(标准状况)CO2(全部逸出)时,吸收液质量就增加10g,则NOx中的x值为 。
(2)尿素也可用于吸收处理NOx,其反应原理为:
NO+NO2+H2O=2HNO2
2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。
当混合气体中NO、NO2按上述反应中系数比时吸收效果最佳。若混合气体中V(NO)∶V(NO2)=3∶1时,可通入一定量的空气,同温同压下,V(空气)∶V(NO)= (空气中氧气的体积含量约为20%)。
(8分)(1)已知2 mol氢气燃烧生成液态水时放出572 kJ热量,反应方程式是2H2(g)+O2(g)===2H2O(l) 请回答下列问题:
①该反应的生成物能量总和________(填“大于”、“小于”或“等于”)反应物能量总和。
②若2 mol氢气完全燃烧生成水蒸气,则放出的热量________(填“>”、“<”或“=”)572 kJ。
(2)FeS2焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g)  2SO3(g) ΔH1=-197 kJ·mol-1;
2SO3(g) ΔH1=-197 kJ·mol-1;
H2O(g)===H2O(l)ΔH2=-44 kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l)ΔH3=-545 kJ·mol-1
则SO3(g)与H2O(l)反应的热化学方程式是________________。
(3)已知下列反应的热化学方程式:
①6C (s)+5H2(g)+3N2(g)+9O2(g)===2C3H5(ONO2)3(l)ΔH1
②2H2(g)+O2(g)===2H2O(g)ΔH2
③C(s)+O2(g)===CO2(g) ΔH3
则反应4C3H5(ONO2)3(l)===12CO2(g)+10H2O(g)+O2(g)+6N2(g)的ΔH为________。
DEHP是一种增塑剂,被塑料工业广泛应用。DEHP有如下转化关系。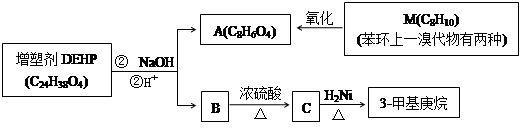
(1)M的结构简式是____________________;
(2)B分子中只有2个甲基,C的主链碳原子数为6,则B的结构简式是__________,化合物C的名称是__________;
(3)写DEHP与NaOH溶液反应的化学方程式______________________________;
(4)F是A的一种同分异构体,具有下列特征:
a.苯的邻位二取代物
b.遇氯化铁溶液显紫色
c.能与碳酸氢钠溶液反应
F与足量碳酸氢钠溶液反应的化学方程式是___________________________________。
肉桂酸异戊酯G(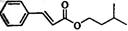 )是一种香料,一种合成路线如下:
)是一种香料,一种合成路线如下: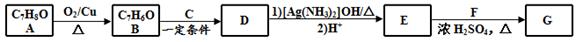
已知以下信息:
① ;
;
②C为甲醛的同系物,相同条件下其蒸气与氢气的密度比为22。
回答下列问题:
(1)A的化学名称为。
(2)B和C反应生成D的化学方程式为。
(3)F中含有官能团的名称为。
(4)E和F反应生成G的化学方程式为,反应类型为。
(5)F的同分异构体中不能与金属钠反应生成氢气的共有 种(不考虑立体异构),其中核磁共振氢谱只有两组峰,且峰面积比为3︰1的为 (写结构简式)。
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4gH2O和8.8gCO2,消耗氧气6.72 L(标准状况下)。有机物A的实验式为____________________。
(2)质谱仪测定有机化合物A的相对分子质量为46,A的核磁共振氢谱如下图所示,则A的结构简式为____________________。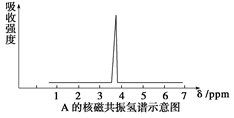
(3)用核磁共振氢谱的方法来研究C2H6O的结构,请简要说明根据核磁共振氢谱的结果来确定C2H6O分子结构的方法是____________________________________________。
完成下列化学方程式
①向苯酚钠溶液中通入少量CO2
②以甲苯为主要原料制TNT(三硝基甲苯)
③溴乙烷与NaOH的乙醇溶液共热
④甲醛与新制的Cu(OH)2反应 ______________________________________________
⑤乳酸(2-羟基丙酸)分子间酯化为六元环酯的反应