A、B、C、D为原子序数依次增大的短周期元素。A原子核外电子有5种运动状态,B是地壳中含量最多的元素,A、C、D未成对电子数比为1:3:1。E有“生物金属”之称,E4+和氩原子的核外电子排布相同,请回答下列问题:(各元素用相应的元素符号表示)
(1)五种元素所形成的XY3型化合物的化学式可能为 ,
其中心原子杂化方式依次为 。
(2)在元素周期表中与C同周期但不同区的金属元素有 种。
(3)B与D形成的以D为中心三原子分子中,B的质量分数约为47%,则分子的空间构型为 。
(4)E的一种氧化物M的晶胞结构如图所示,则M的
化学式为 ,该晶体中氧原子的配位数为 。
(5)下列晶体的堆积方式与E的单质晶体的堆积方式
相同的有 。
①Po ②Zn ③Ag ④K
(6)B可形成两种同素异形体,其中在水中溶解度更大的是 (填化学式),原因是 。
(12分) 如下图所示,在一个烧瓶中充满气体A,打开①处的止水夹向烧瓶中缓慢通入等体积的气体B后关闭该止水夹,待充分反应后再打开②处的止水夹。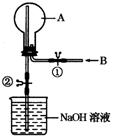
(1)请按要求填表回答打开②处的止水夹前烧瓶中所观察到的现象并按要求书写反应的化学方程式: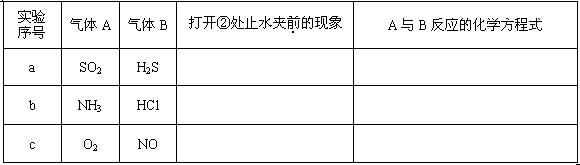
(2) 打开②处的止水夹后,烧瓶内剩余气体最多的是(填实验序号)____________。
(10分) 硫酸的消费量是衡量一个国家化工生产水平的重要标志。
(1)V2O5是SO2与O2反应的催化剂,请写出该反应的方程式:
_____________________________________________________________________。
(2)一定条件下,SO2与空气反应10 min后,SO2和SO3物质的量浓度分别为1.2 mol/L和2.0 mol/L,则SO2起始物质的量浓度为_____________;生成SO3的化学反应速率为_________________。
(3)若改变外界条件,发生SO2与空气反应生成SO3,使10 min内的用O2表示的反应速率为0.15mol/(L·min),则改变的条件可能是_______________。
| A.压缩体积,增大压强 | B.降低温度 |
| C.充入大量的氮气 | D.仅增加SO2的浓度 |
(4)工业制硫酸,用过量的氨水对SO2尾气处理,请写出相关的离子方程式
______________________________________________________。
(10分) 按要求填空
(1)配平下列化学方程式:
______P + ________FeO + _______CaO =_______Ca3(PO4)2 +_________Fe
(2)制造光导纤维的材料是_________;三硅酸镁(Mg2Si3O8·11H2O)用氧化物表示_______________________。
(3)除去NaHCO3溶液中少量的Na2CO3杂质相应的离子方程式为__________________________________________。
(4)检验SO42-所需要用的试剂__________________和__________________。
(14分)有X、Y、Z、W、M五种短周期元素,它们满足如下关系:①原子序数依次增大;②ZX4++WX-=ZX3+X2W,且反应物和产物中各微粒的电子总数与M+相等,均为10个;③Z2与YW分子中质子数相等。回答下列问题:
(1)YW2的电子式:;实验室中MWX溶液的保存方法是:
(2)由X、Y、Z、W四种元素共同组成的离子化合物A,其原子个数比为5:1:1:3,则A的水溶液与足量的MWX溶液反应的离子方程式为:
(3)M2W2投入足量Na2S溶液中,生成浅黄色沉淀的离子方程式为:
(4)与M同族的元素B和B2W共n 克投入到足量的X2W中完全反应,生成物蒸干后得1.25n 克化合物BWX,B是(填元素名称)。
(6分)有一固体混合物,可能由Na2CO3、K2SO4、CuSO4、Ca(NO3)2、KCl、AgNO3等混合而成,为检验它们,做了如下实验:①将固体混合物溶于水,搅拌后得无色透明溶液;②往此溶液中滴加BaCl2溶液,有白色沉淀生成;③过滤,将沉淀物置于足量稀硝酸中,发现沉淀全部溶解。试判断:
(1)固体混合物中肯定有,肯定没有,可能;(用化学式填写)
(2)写出实验③中发生的反应的离子方程式:。