根据已学知识,请你回答下列问题:
(1)元素的原子最外层电子排布式为nsnnpn+1,该元素的名称为______________;
(2)C、N、O、F电负性由大到小的顺序是 ;
(3)铜基态核外电子排布式是________ _;
(4)钛的基态M能层电子排布图 ;
(5)C、N、O、F第一电离能由大到小的顺序是 ;
(6)铬元素在周期表中位于__________区;
(7)一至四周期中,未成对电子数和能层数相等的元素有 种;
(8)仅由第二周期元素组成的共价分子中,互为等电子体的是CO2和_________;N2和________。
(9)CH2=CH2中碳原子采取 杂化;
(10)水分子的空间构型为 。
有以下各组微粒或物质:
| A.氯水和氯气; | B.35Cl和37Cl; | C.冰和干冰; | D.金刚石、石墨和C60 |
E、CO和CO2; F、氘和氚; G、O2和 O3; H、正丁烷和异丁烷;
其中,(1)互为同分异构体的有(填编号,以下同);
(2)互为同素异形体的有;
(3)互为同位素的有。
有下列八种物质:①氯化钡、②金刚石、③硫、④二氧化硅、⑤氯化钠、⑥干冰
回答有关这六种物质的问题。
(1)将这六种物质按不同晶体类型分成三组,并用编号填写下表:
| 各组中物质的编号 |
|||
| 晶体类型 |
分子晶体 |
原子晶体 |
离子晶体 |
其中以共价键相结合,原子彼此间形成空间网状结构的化合物是(填编号)。晶体内存在单个分子的化合物是(填编号)。
0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5千焦热量,其热化学方程式是,
又已知:H2O(液)=H2O(气);△H =+44kJ/mol,则11.2升(标准状况下)乙硼烷完全燃烧时生成气态水时放出的热量为。
用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
(1)实验过程如下图所示,分析判断:________段化学反应速率最快。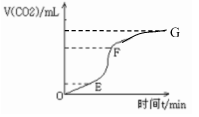
(2)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是()
| A.蒸馏水 | B.氯化钠固体 |
| C.氯化钠溶液 | D.浓盐酸 |
(3)除了上述方法外,你认为还可以采取哪些措施来减缓化学反应速率?(至少回答两种)
U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
⑴.V的单质分子的结构式为_______________;XW的电子式为____________;U元素在周期表中的位置是_____________。
⑵.U元素形成的同素异形体的晶体类型可能是(填序号)__________。
①原子晶体②离子晶体③分子晶体④金属晶体
⑶.U、V、W形成的10电子氢化物中,U、V、W的氢化物沸点最高的是(写化学式)____________;V、W的氢化物分子结合H+能力较强的是(写化学式)______________,用一个离子方程式加以证明___________________________________________。