(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示_____________, K值大小与温度的关系是:温度升高,K值______________。(填一定增大、一定减小、或可能增大也可能减小);
(2)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
CO(g) +H2O(g)  CO2(g) +H2 (g) △H<0。
CO2(g) +H2 (g) △H<0。
CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=_________mol·L-1·min-1。
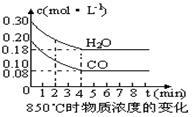
(3)该反应的化学平衡常数表达式为K= _,850℃时当反应进行到4min时即达到平衡状态,这时化学平衡常数的数值为 。
找出物质之间的相互联系和区别,从中发现规律,这是我们学好化学的一种基本方法。下面是五种含氮元素物质的化学式:
a.N2 b.NH3 c.N2O4 d.N2O e.HNO3 请你回答:
(1)五种物质中氮元素的化合价由低到高的顺序是____(用序号表示)。
(2)仔细观察,在这五种物质中,你还可以发现其它几个规律,请你写出其中一个,并排列成序(排列顺序用序号表示):
规律:______________________________________;排序:_______________________。
用适当的化学用语填空:
(1)①一个铜原子②3个铝离子__________
③4个质子 ④铵根离子中氮元素的化合价
⑤氧化铁 ⑥硝酸银
⑦CO32-中数字“2”的含义_________________________
⑧写出一种质子数为9且电子数为10的微粒符号
(2)某粒子M2+核外有10个电子,其核内中子数为12,则M元素的相对原子质量为。
(3)一个A原子的质量为a克,一个氧原子的质量为b克,现以氧原子质量的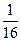 为标准,则AO2的相对分子质量为。
为标准,则AO2的相对分子质量为。
白色粉末A由Na2SO3、Na2SO4 和NaCl等物质中的二种或三种混合而成,取一定量A样品,投入100 mL 2.2 mol·L-1 盐酸中,充分反应后过滤,最终得到100 mL含H+ 的物质的量浓度为1 mol·L-1 的滤液。若将此滤液蒸干,只得到8.19g纯净物B。
(1)B的化学式;
(2)则所取的A样品中含有的各物质的物质的量分别为;
该样品与投入的盐酸反应后生成气体的体积为(标准状况)。
实验室只有36.5%(d=1.19)的浓盐酸,现需配制100mL10%(d=1.08)的盐酸,需36.5%的浓盐酸__________mL。在配制过程中,用到的仪器除烧杯、量筒、玻璃棒、胶头滴管外,还需要____________。定容时,如果眼睛仰视刻线,配制的溶液的浓度将__________(填偏高,偏低,无影响),10%的盐酸逐滴加入到纯碱溶液中,反应的离子方程式为;
将一定质量的铁投入20 mL浓硫酸中,加热充分反应后固体有剩余并收集气体4.48 L(标准状况),质量为6.6 g;则
(1)参加反应的铁的质量为 .
(2)硫酸溶液的物质 的量浓度为 .
的量浓度为 .