随着工业的迅速发展,产生的废水对水体的污染也日趋严重。通过控制溶液的pH对工业废水中的金属离子进行分离是实际工作中经常使用的方法。下表是常温下金属氢氧化物的Ksp(沉淀溶解平衡常数)和金属离子在某浓度下开始沉淀所需的pH(表中浓度为相应pH时溶液中有关金属离子产生沉淀的最小浓度;当溶液中金属离子浓度小于10-5 mol•L-1时通常认为该离子沉淀完全)。
| 金属离子 |
Ksp |
pH(10-1 mol•L-1) |
pH(10-5 mol•L-1) |
| Fe3+ |
4.0×10-38 |
2.7 |
3.7 |
| Cr3+ |
6.0×10-31 |
4.3 |
5.6 |
| Cu2+ |
2.2×10-20 |
4.7 |
6.7 |
| Ca2+ |
4.0×10-5 |
12.3 |
14.3 |
(1)某厂排出的废水中含有Cu2+和Fe3+,测得其浓度均小于0.1 mol•L-1。为除去其中的Fe3+,回收铜,需控制的pH范围是_______________________________。
(2)为了处理含有Cr2O72-酸性溶液的工业废水,采用如下方法:向废水中加人适量NaCl,以Fe为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成排出,从而使废水中铬含量低于排放标准。
①Cr2O72-转变为Cr3+的离子方程式为______________________。
②pH对废水中Cr2O72-去除率的影响如图。你认为电解过程中溶液的pH取值在______范围内对降低废水中的铬含量最有利,请说明理由:_________________________________。
[注:去除率(%)=[(c0-c)/co]×100%,式中:co—处理前废水中Cr2O72-浓度,c—处理后废水中Cr2O72-的浓度]
(3)沉淀转化在生产中也有重要应用。例如,用Na2CO3溶液可以将锅炉水垢中的CaSO4转化为较疏松而易清除的CaCO3,该沉淀转化达到平衡时,其平衡常数K=_________(写数值)。[已知Ksp (CaSO4)=9.1x10-6,Ksp (CaCO3)=2.8×10-9]
材料是人类赖以生存的重要物质基础。材料种类很多,通常可分为金属材料、无机非金属材料(包括硅酸盐材料)、高分子合成材料及复合材料。
(1)①合金是生活中常见的材料。某合金具有密度小、强度高的优良性能,常用于制造门窗框架。该合金中含量最高的金属为(填元素符号)。
②铁锈的主要成分是(填化学式),它是钢铁在潮湿的空气中发生腐蚀的结果,其负极反应式为。 ③玻璃是一种常用的硅酸盐材料。制备普通玻璃的原料有CaCO3、和(填化学式)。
③玻璃是一种常用的硅酸盐材料。制备普通玻璃的原料有CaCO3、和(填化学式)。
(2)聚苯乙烯是造成白色污染的物质之一,其结构简式为 ,则制取聚苯乙烯的单体是。
,则制取聚苯乙烯的单体是。
保持营养平衡,合理使用药物是保证身心健康、提高生活质量的有效手段。
(1)①人类的生命活动需要糖类、、维生素、水、和无机盐(或矿物质)等六大素营养物质。
②阿司匹林具有作用。长期大量服用阿司匹林,其水解产物水杨酸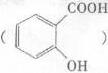 可导致患者出现头痛、恶心等症状,需静脉注射小苏打(NaHCO3)溶液,利用小苏打与水杨酸分子中的羧基反应生成水杨酸钠,使症状缓解。写出水杨酸与小苏打反应的化学方程式:。
可导致患者出现头痛、恶心等症状,需静脉注射小苏打(NaHCO3)溶液,利用小苏打与水杨酸分子中的羧基反应生成水杨酸钠,使症状缓解。写出水杨酸与小苏打反应的化学方程式:。
(2)蛋白质在人体内水解的最终产物是氨基酸。请在下图虚 线方框内写上适当的官能团符号,将氨基酸的通式补充完整:
线方框内写上适当的官能团符号,将氨基酸的通式补充完整: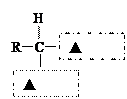
(3)淀粉水解的最终产物是若要检验淀粉的淀粉酶作用下已经发生了水解,可取少量上述溶液加入碱液调到碱性,再加入(填试剂的名称),加热后再根据实验现象判断;若要检验淀粉没有完全水解的,可取少量上述溶液加入几滴溶液,应观察到出现蓝色。
(1)(3分)防治环境污染,改善生态环境已成为全球的共识。
①空气质量报告的各项指标可以反映出各地空气的质量。下列气体已纳入我国空气质量报告的是(填字母)。
a.CO2b.N2c.NO2
②垃圾应分类收集。导致“白色污染”的生活垃圾应放置于贴有(填字母)标志的垃圾筒内。
③工业废水需处理达标后才能排放。下列废水处理的方法合理的是(填字母)。
a.用中和法除去废水中的酸
b.用混凝剂除去废水中的重金属离子
c.用氯气除去废水中的悬浮物
(2)酸雨是指pH___________的降水,大量燃烧含硫煤产生气体随雨水降落到地面,pH随时间变长会有所减小,试用化学方程式解释其原因。

(3)汽车尾气中一氧化氮与一氧化碳催化转化的 化学方程式为。北京奥运各场馆都提供“直饮水”,前期处理阶段常常加入明矾和ClO2处理水,明矾中的Al2(SO4)3在水中生成带正电的Al(OH)3胶体,发生反应的离子方程式是,ClO2的作用是。
化学方程式为。北京奥运各场馆都提供“直饮水”,前期处理阶段常常加入明矾和ClO2处理水,明矾中的Al2(SO4)3在水中生成带正电的Al(OH)3胶体,发生反应的离子方程式是,ClO2的作用是。
I.Zn – MnO2干电池应用广泛,其电解质溶液是ZnCl2一NH4Cl混合溶液。
(1)该电池的负极材料是。电池工作时,电子流向极(填“正”、“负”)。
(2)若ZnCl2- NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,欲除去Cu2+,最好选用下列试剂中的(填代号)
| A.NaOH | B.Zn | C.Fe | D.NH3.H2O |
Ⅱ.下图是甲烷燃料电池原理示意图,请回答下列问题: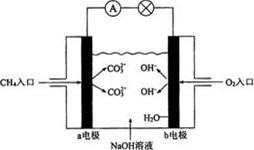
(3)电池的正极是(填“a”或“b”)电极,负极上的电极反应式是。
(4)电池工作一段时间后电解质溶液的pH(填“增大”、“减小”、“不变”)
A、B、C、D均为中学常见物质,其中A为单质,B、C、D为化合物 ,并且存
,并且存 在如下转换关系:
在如下转换关系:
试回答下列问题:
(1)若B与C为氧化物,D为纯碱。
a.当A为非金属单质时,则反应③的化学方程式为。
b.当A为金属单质时,则反应④中生成1mol纯碱转移电子数为mol。
(2)若A为淡黄色非金属单质,B为气态氢化物,C为气态氧化物。 B与C反应中氧化剂与还 原剂的质量比为。
原剂的质量比为。
(3)若A为金属单质,B为氧化物,且反应①③均是与强碱溶液发生的反应,则反应①的离子方程式为。