植物精油具有抗菌消炎、解热镇痛等药物功效。从樟科植物枝叶中提取的精油中含有甲、乙、丙三种成分。
Ⅰ.甲经下列过程可转化为乙
(1)反应①的反应类型为 。
(2)乙的结构简式为 ,1mol乙最多可与 mol H2反应。
Ⅱ通过下列合成路线由乙可得到丙(部分反应产物略去)
已知下列信息: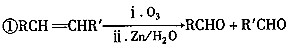
②丙的分子式为C16H14O2,能与溴水、NaOH溶液反应。
(3)A的名称是 。B→C的反应条件为 。
(4)乙与新制Cu(OH)2反应的化学方程式为 。
写出同时符合下列要求的D的同分异构体的结构简式: 。
属于二取代苯
b.分子中有5种不同化学环境的氢原子,其个数之比为1:2:2:1:2
c.能使溴的CCl4溶液褪色,且在酸性条件下可以发生水解反应
(13分)铬酸铅俗称铬黄,不溶于水。广泛用于涂料、油墨、漆布、塑料和文教用品等工业。实验室模拟工业上用铬污泥(含有Cr2O3、Fe2O3、Al2O3、SiO2等)制备铬黄的工艺流程如下: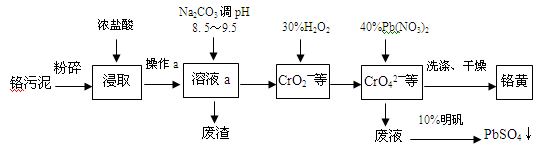
(1)操作a的名称为。
(2)在浸取过程中浓盐酸与Fe2O3的离子方程式。
(3)写出加入30%H2O2过程中发生的离子反应方程式:。
(4)加入Pb(NO3)2沉淀CrO42-时,检验沉淀是否完全的方法是。
(5)在废液中加入10%明矾溶液发生反应的离子方程式为。
(6)由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍.因此,必须对含铬的废水进行处理,将含Cr2O72-的酸性废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。阳极区生成的Fe2+和Cr2O72
 -发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去。
-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去。
①请分析电解过程中溶液pH不断上升的原因。
②当电路中通过3mol电子时,理论上可还原的Cr2O72-的物质的量为mol。
在一个U形管里盛有氯化铜溶液,并插入两块纯锌片作电极,如下图:
(1)如果把电键K接A,这一装置形成电解池装置,____是阳极,其电极反应式是_________________;
(2)上述反应进行5min后,转换电键K到C,这一装置形成原电池装置,________极是负极,该装置发生反应的总化学方程式是______________
(3)上述装置进行2min后,再转换电键K到B,在极上发生的腐蚀属于电化学腐蚀。
已知H2A在水中存在以下平衡:H2A H++HA-,HA-
H++HA-,HA- H++A2-。回答以下问题:
H++A2-。回答以下问题:
(1)已知常温下,H2A的钙盐(CaA)饱和溶液中存在平衡:
CaA(s) Ca2+(aq)+A2-(aq) ΔH > 0。
Ca2+(aq)+A2-(aq) ΔH > 0。
①温度升高时,Ksp_______(填“增大”、“减小”或“不变”下同)。
②滴加少量浓盐酸,c (Ca2+)________,原因是___________ (用文字和离子方程式说明)。
(2)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式______。若某CuSO4溶液中c (Cu2+)=0.02 mol/L,如果要生成Cu(OH)2沉淀,应调整溶液pH,使之大于5 (已知Ksp[Cu(OH)2]=2.0×10-20)。
(1)有下列物质:①铜 ②硫酸钡固体 ③氨水 ④氢氧化钠固体 ⑤熔融硝酸钾 ⑥乙醇
⑦稀硫酸 ⑧金刚石 ⑨二氧化硫 ⑩冰醋酸。
属于非电解质的有_____;属于强电解质的有_____;(填序号)
(2)常温下,将pH=3的盐酸和pH=11的氨水等体积混合后溶液呈性,溶液中c(NH4+)与c(Cl-)的大小关系是:c(NH4+)c(Cl-);(填>,<或=)
(3)常温下,0.010mol·L-1盐酸和0.010mol·L-1氨水的pH之和14,常温下,pH=2的盐酸和pH=12的氨水,分别加水稀释10倍后,两溶液的pH之和14(填>,<或=)
甲醇可通过将煤的气化过程中生成的CO和H2在一定条件下发生如下反应制得:CO(g) + 2H2(g)=CH3OH(g)
请根据下图回答下列问题:
(1)从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=____mol / (L·min)。
(2)写出该反应的热化学方程式____________________________________________
(3)恒容条件下,下列措施中能使 n(CO) n(CH3OH)增大的有。
A.升高温度B.充入He气
C.再充入1 mol CO和2 mol H2D.使用催化剂
(4)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
| 容器 |
反应物投入的量 |
反应物的转化率 |
CH3OH的浓度 |
能量变化(Q1、Q2、Q3均大于0) |
| 甲 |
1 mol CO和2 mol H2 |
a1 |
c1 |
放出Q1kJ热量 |
| 乙 |
1mol CH3OH |
a2 |
c2 |
吸收Q2kJ热量 |
| 丙 |
2mol CO和4 mol H2 |
a3 |
c3 |
放出Q3kJ热量 |
则下列关系正确的是:
A. c1=c2
B.2Q1=Q3 ……
C.2a1=a3
D. a1+ a3=1
E.该反应若生成1 mol CH3OH,则放出(Q1+ Q2)kJ热量
(5)若在一体积可变的密闭容器中充入1molCO、2mol H2和1mol CH3OH,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则该反应向(填“正”、“逆”)反应方向移动,理由是由质量守恒,密度为原来的1.6倍,所以体积缩小,平衡正移。