(1)有下列物质:①铜 ②硫酸钡固体 ③氨水 ④氢氧化钠固体 ⑤熔融硝酸钾 ⑥乙醇
⑦稀硫酸 ⑧金刚石 ⑨二氧化硫 ⑩冰醋酸。
属于非电解质的有_____;属于强电解质的有_____;(填序号)
(2)常温下,将pH=3的盐酸和pH=11的氨水等体积混合后溶液呈 性,溶液中c(NH4+)与c(Cl-)的大小关系是:c(NH4+) c(Cl-);(填>,<或=)
(3)常温下,0.010mol·L-1盐酸和0.010mol·L-1氨水的pH之和 14,常温下,pH=2的盐酸和pH=12的氨水,分别加水稀释10倍后,两溶液的pH之和 14(填>,<或=)
巳知:RCH2Cl + NaOH → RCH2OH +NaCl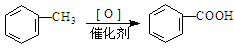
有机物E和F可用作塑料增塑剂或涂料的溶剂,它们的分子量相等。可以用下列方法合成。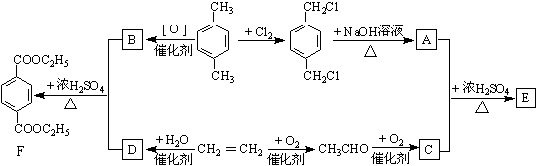
(1)写出有机物B的结构简式:
(2)写出有机物F名称:
(3)写出下列反应的化学方程式,并指出反应类型.
①A+C→E:
②CH2=CH2 D:
D:
(4)E和F的相互关系是(少选或多选扣分)
| A.同一种物质 | B.同一类物质 | C.同系物 | D.同分异构体 |
(1)用系统命名法命名下列物质
①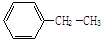 ________
________
② CH3CH2CH=CHCH3 ________
(2)写出结构简式或名称:
①分子式为C8H10的芳香烃,苯环上的一溴取代物只有一种,写出该芳香烃结构简式_______
②戊烷(C5H12)的某种同分异构体只有一种一氯代物,写出该戊烷的名称________
(3)某有机物A的结构简式如图。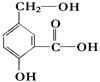
①写出A中官能团的名称
②写出A跟NaOH溶液反应的化学方程式是
③A跟NaHCO3溶液反应的化学方程式是: _______________
④A在一定条件下跟Na反应的化学方程式是:
(1)按官能团的不同可以对有机物进行分类,请指出下列有机物的种类,填在横线上。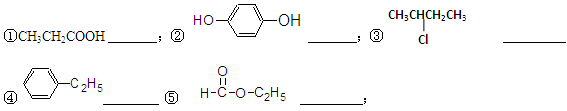
(2)化合物A和B的分子式都是C2H4Br2, A的核磁共振氢谱图如图所示,则A的结构简式为:,请预测B的核磁共振氢谱上有个峰(信号)。
A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应。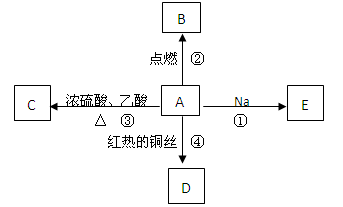
(1)写出A的化学式。
(2)下列反应的化学方程式
反应①;
反应③;
反应④。
(3)比较反应①与钠和水反应的现象有什么相同和不同。
相同点: ;
不同点:
(8分)在利用CaCO3与盐酸反应制取二氧化碳的反应中,反应中生成二氧化碳的体积与反应时间的关系如图所示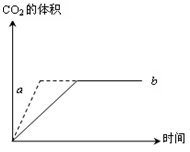
两个实验所用的盐酸浓度相同,其中一个实验用是石灰石块,,另一实验用是石灰石粉末,则从图中可以看出:
①使用石灰石块的是 (填a或b,下同),反应速率较快的曲线是,由b图变为a的原因是  ②如果实验过程中所用的盐酸是过量的,则所取块状石灰石与粉末状石灰石的质量是否相等?(填“相等”或“不相等”)。
②如果实验过程中所用的盐酸是过量的,则所取块状石灰石与粉末状石灰石的质量是否相等?(填“相等”或“不相等”)。