(14分)研究表明:丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环。
(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下转化生成甲醇蒸汽和水蒸气。下图1表示恒压容器中0.5 mol CO2和1.5 mol H2转化率达80%时的能量变化示意图。写出230℃该反应的热化学方程式: _______________ 。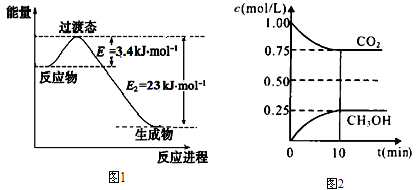
(2)在一定温度下的2L固定容积的密闭容器中,通入2mol CO2和3mol H2,测得CO2(g)和CH3OH(g)的浓度随时间变化如上图2所示。
①能说明该反应已经达到平衡状态的是_______________。(选填编号)
A.CO2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O
D.该体系中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
②计算该温度下此反应的平衡常数K=________。(保留两位有效数字)。若改变条件 (填选项),可使K=1。
A.增大压强
B.增大反应物浓度
C.降低温度
D.升高温度
E.加入催化剂
(3)某甲醇燃料电池原理如图1所示。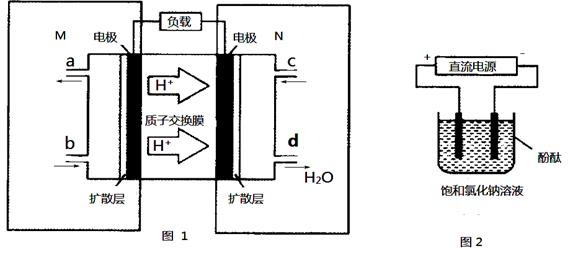
①M区发生反应的电极反应式为_________________________。
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),则该电解的总反应离子方程式为: 。假设溶液体积为300 mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为_______(忽略溶液体积变化)。
写出下列化学方程式(共6分)
(1) 乙炔与氯化氢按物质的量比1:1反应
(2) 苯与浓硝酸、浓硫酸的混合酸共热__________
下图表示4个碳原子相互结合的方式。小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合(氢原子省略)。回答下列问题: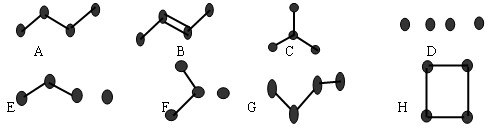
(1)在上图的有机化合物中,碳原子与碳原子之间不仅可以形成共价单键,还可
以形成 和 ,还可以形成碳环。
(2)图中属于烯烃的是(填编号)
(3)与A 互为同分异构体的是(填编号)
( 4) 写出上图中B、C、G的结构简式
B 、C 、G .
如图所示,试回答下列问题 (灯泡功率合适):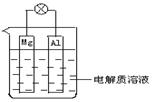
(1)该装置是(填“原电池”或“电解池”.)
(2)电解质溶液为稀H2SO4时,灯泡
(填“亮”或“不亮”,填 “亮”做a题,
填“不亮”做b题).
a.若灯泡亮,则Mg电极上发生的反应为:
Al电极上发生的反应为:
b.若灯泡不亮,其理由为:
(3)电解质溶液为NaOH(aq)时,灯泡
(填“亮”或“不亮”, 填“亮”做a题,填“不亮”做b题).
a.若灯泡亮,则Mg电极为:极;Al电极为:极(填“正”“负”)
b.若灯泡不亮,其理由为:.
0.15mol某金属单质与足量的稀硫酸充分作用后,在标准状况下生成5.04L氢气和25.65g该金属的硫酸盐,若该金属原子核内的质子数比中子数少1个,试通过计算推导出该元素的原子序数,并指出其在周期表中的位置。
下图转化关系中,A、B、C、D、E都是短周期元素的单质,在常温常压下A是固体,其余都是气体,且C呈黄绿色。化合物H和I两种气体相遇时产生白烟。化合物G的焰色反应为黄色。反应①和②均在溶液中进行。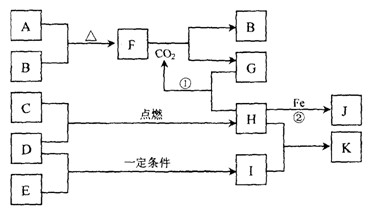
请按要求回答下列问题。
(1)写出下列物质的化学式D、F
(2)反应①的离子方程式为。
(3)向K溶液中加入硝酸酸化的硝酸银溶液,反应的现象为。
(4)将少量单质C通入盛有淀粉KI溶液的试管中,液体变为蓝色。该反应的离子方程式为。这说明单质C的氧化性于单质碘(填“强”或“弱”)。