工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下: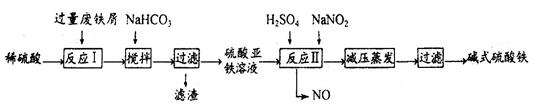
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1)反应I溶液中存在的金属阳离子有__________________。
(2)加入NaHCO3的目的是调节pH,使溶液中的______(填“Fe3+”、“Fe2+”或“A13+”)沉淀。该工艺流程中“搅拌”的作用是_____________。
(3)反应II的离子方程式为__________。在实际生产中,反应II常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作为________。若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2物质的量为__________。
(4)碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子。该水解反应的离子方程式为__________________________。
淀粉和纤维素的分子组成都可以用通式____表示,蛋白质水解的最终产物分子中,含有的官能团是 _和( 填官能团名称)。
下表是某地区市场上销售的一种“加碘食盐”包装袋上的部分文字说明。请根据此表,结合化学和生物学科的知识,回答下列问题。
(1)要在食盐中加碘,是因为碘是人体内合成____________激素的主要原料,缺碘会引起疾病。
(2)食盐中加碘,这碘指的是(填化学式),其中碘元素的化合价为__________。
(1)维生素C的结构简式为 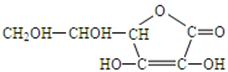
请回答:①维生素C的分子式是
②向维生素C的水溶液中滴加紫色石蕊试液,试液变红,说明维生素C的水溶液显性。
(2)铁在人体内不是以单质的形式存在,而是以Fe2+和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收。
维生素C在这一反应中具有性;维生素C又称为。
(3)黄瓜中含有多种营养成分,尤其是维生素C和B的含量比西瓜高出1~5倍。已知高温时维生素会被破坏,维生素C在酸性环境时较稳定。根据上述内容,你认为应如何合理的食用黄瓜?
(1)水在人体内有重要作用,请列举出其中两点:
①
②
(2)水资源非常短缺,请列举两条生 活中节约用水的具体措施
活中节约用水的具体措施
① 
②
(1)下表是某食品包装袋上的说明,从表中的配料中分 别选出一种物质填在相应的横线上。
别选出一种物质填在相应的横线上。
| 品名 |
浓缩菠 萝汁 萝汁 |
| 配料 |
水、浓缩菠萝汁、蔗糖、柠檬酸、甜蜜素、维生素C、菠萝香精、柠檬黄、日落黄、山梨酸钾等。 |
其中属于着色剂的有______________,属于调味剂的有__________________,
属于防腐剂的有_________________,富含维生素的有___________________。
(2)亚硝酸钠有毒,其外观和咸味与食盐很相似,因此要防止因误食亚硝酸钠而发生事故。亚硝酸钠和氯化钠的部分性质如下表:
| 性质 |
亚硝酸钠 |
氯化钠 |
| 1.酸性条件下的稳定性 |
微热时分解为NO和NO2 |
微热时不分解 |
| 2.熔点 |
271℃ |
801℃ |
| 3.室温时的溶解度 |
约80g |
约35g |
请根据表中信息设计一种鉴别NaNO2和NaCl的方法,写出简单的操作过程、现象和结论:_________________________________________