已知化合物A、D、E、G焰色反应时,火焰均呈黄色,其中A可用作家庭食品添加剂,也可用以治疗胃酸过多。A~H各物质的变化关系如下图所示。
(1)写出各步反应的化学方程式
反应① 反应②
反应③ 反应④
反应⑤
(2)上述反应中属于氧化还原反应的有
下列物质:①石墨 ②三氧化硫 ③液态氯化氢 ④氯气 ⑤熔融的硫酸钾 ⑥氯化钠晶体 ⑦硫酸溶液 ⑧乙醇 ⑨冰醋酸 ⑩NH3·H2O
其中能够导电的是______________________;(填序号,下同)
强电解质是____________________________;
弱电解质是____________________________;
非电解质是____________________________。
298K时,合成氨反应的反应热△H=-92.4 kJ·mol-1。在该温度下,取1mol N2和3molH2放在一个密闭的容器中,在催化剂存在下进行反应,测得反应放出的热量总是小于92.4kJ。其原因是_______________。
写出下列反应的热化学方程式。
(1)4g硫粉完全燃烧生成二氧化硫气体,放出37kJ热量_______________________________
(2)9g铝与足量氯气化合生成固体氯化铝,放出热量274.2kJ___________________________
某课外兴趣小组对H2O2的分解速率做了如下实验探究。下表是该小组研究影响过氧化氢分解速率的因素时采集的一组数据:用10 mL H2O2制取150 mL O2所需的时间(秒)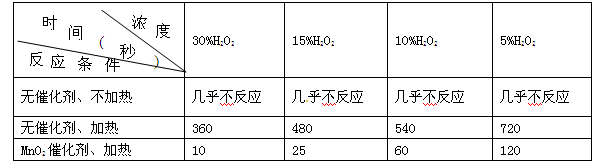
(1)该研究小组在设计方案时,考虑了浓度、____________、____________等因素对过氧化氢分解速率的影响;
(2)若已知1 克液态过氧化氢分解成氧气和液态水时,可放出2.89 kJ能量,写出该反应的热化学方程式:____________________;
(3)产生的O2充入某密闭容器,发生4NH3(g)+5O2(g) 4NO(g)+6H2O(g),不同情况测得反应速率,其中反应速率最快的是_________
4NO(g)+6H2O(g),不同情况测得反应速率,其中反应速率最快的是_________
| A.υ(NH3)="0.4" mol / (L·s) |
| B.υ(O2)="0.5" mol / (L·s) |
| C.υ(NO)="0.6" mol / (L·s) |
| D.υ(H2O)="1" mol / (L·min) |
A、B、C、D、E、F是原子序数小于20的四种元素,已知A元素+1价的阳离子与C的阳离子具有相同的电子层结构,B元素最高正价的绝对值与负价的绝对值之差等于6。1molC单质与足量的稀硫酸反应可生成1.5molH2,反应后C元素原子形成的离子和氖原子的电子层结构相同。以D元素为核心可以形成种类最多的一类化合物。E的单质是密度最小的物质。F原子的最外层电子数是核外电子总数的 ;
;
(1)写出A、C两元素最高价氧化物的水化物间反应的离子方程式___________________________;
(2)比较B与C元素形成离子的半径:B元素形成的离子半径______C元素形成的离子半径(填“>”、“=”或“<”)
(3)D与F形成的一种化合物是参与大气循环的气体,写出它的电子式________________;