(13分)铬酸铅俗称铬黄,不溶于水。广泛用于涂料、油墨、漆布、塑料和文教用品等工业。实验室模拟工业上用铬污泥(含有Cr2O3、Fe2O3、Al2O3、SiO2等)制备铬黄的工艺流程如下: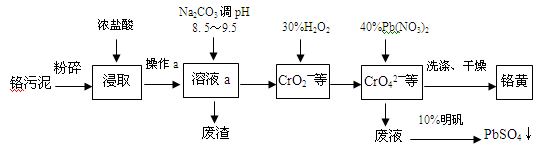
(1)操作a的名称为 。
(2)在浸取过程中浓盐酸与Fe2O3的离子方程式 。
(3)写出加入30%H2O2过程中发生的离子反应方程式: 。
(4)加入Pb(NO3)2沉淀CrO42-时,检验沉淀是否完全的方法是 。
(5)在废液中加入10%明矾溶液发生反应的离子方程式为 。
(6)由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍.因此,必须对含铬的废水进行处理,将含Cr2O72-的酸性废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。阳极区生成的Fe2+和Cr2O72
 -发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去。
-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去。
①请分析电解过程中溶液pH不断上升的原因 。
②当电路中通过3mol电子时,理论上可还原的Cr2O72-的物质的量为 mol。
干冰晶胞中平均含有个CO2分子;CO2分子的排列方向有种;与一个CO2分子距离最近且相等的CO2分子共有个。
现有三种物质A、B、C,其中有一种是酸,一种是碱,一种是盐,溶于水后电离,可以产生下表中的离子:
| 阳离子 |
Na+ H+Ba2+ |
| 阴离子 |
OH- CO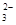 SO SO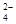 |
为鉴别它们,分别完成以下实验,其结果如下:
① A溶液与B溶液反应生成无色气体X,气体X可以和C溶液反应生成沉淀E,沉淀E可与B溶液反应;
② B溶液与C溶液反应生成白色沉淀D,沉淀D不溶于稀硝酸。
请根据上述实验结果,填空:
(1) 鉴别某溶液中是否含有B中阴离子的实验操作方法是:
(2)完成以下水溶液中的反应的离子方程式:
A溶液与B溶液反应:;
B溶液与沉淀E反应:;
(3) D与E的混合物a g,加入足量盐酸,反应完全生成标准状况时的气体b L,则E在混合物中的质量分数为。
现有下列十种物质:①H2 ②铝 ③CaO ④CO2⑤H2SO4 ⑥Ba(OH)2
⑦红褐色的氢氧化铁液体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3
(1)上述物质中属于电解质有:(用物质序号填空),
可以利用⑦具有现象这一简单物理方法区分⑦、⑧二种分散系。
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH- H2O,该离子反应对应的化学方程式为。
H2O,该离子反应对应的化学方程式为。
少量的④通入⑥的溶液中反应的离子方程式为。
(3)17.1g⑩溶于水配成250mL溶液,SO42-的粒子数为,
SO42-的物质的量浓度为。
(4)②与⑨发生反应的化学方程式为:Al + 4HNO3 = Al(NO3)3 + NO↑ + 2H2O,
写出该反应的离子方程式并标出电子转移方向和数目:
当有4.48升(标况)NO气体产生时,转移电子的物质的量为,被还原HNO3的质量为克。
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
⑴ Y在元素周期表中的位置为________________。
⑵ 上述元素的最高价氧化物对应的水化物酸性最强的是_______________(写化学式),非金属气态氢化物还原性最强的是__________________(写化学式)。
⑶ Y、G的单质或两元素之间形成的化合物可作水消毒剂的有___________(写出其中两种物质的化学式)。
⑷ X2M的标准燃烧热ΔH=-a kJ·mol-1,写出X2M燃烧反应的热化学方程式:
____________________________________________________________________。
⑸ ZX的电子式为________;ZX与水反应放出气体的化学方程式为___________。
下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如下图所示(部分产物及反应条件已略去)。已知A、B为气态单质,F是地壳中含量最多的金属元素的单质;E、H、I为氧化物,E为黑色固体,I为红棕色气体;M为红褐色沉淀。
请回答下列问题:
(1)B中所含元素位于周期表中第周期,族。
(2)A在B中燃烧的现象是。
(3) 的反应中,被氧化与被还原的物质的物质的量比是。
的反应中,被氧化与被还原的物质的物质的量比是。
(4)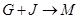 的离子方程式是。
的离子方程式是。
(5)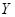 受热分解的化学方程式是。
受热分解的化学方程式是。