(共10分) 甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。反应Ⅰ:CO(g)+2H2(g)  CH3OH(g),△H1
CH3OH(g),△H1
反应Ⅱ:C02(g)+3H2(g)  CH30H(g)+ H2O(g),△H2
CH30H(g)+ H2O(g),△H2
下表所列数据是反应I在不同温度下的化学平衡常数(K):
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.O |
0.27 |
0.012 |
(1)在一定条件下将2 molCO和6molH2充入2L的密闭容器中发生反应I,5min后测得c(CO)="0.4" mol/L,计算此段时间的反应速率(用H2表示) mol/(L·min)。
(2)由表中数据判断△H1 0(填“>”、“<”或“=”)反应C02(g)+H2(g) CO(g)+H20(g)△H3= (用△H1和△H2表示)。
CO(g)+H20(g)△H3= (用△H1和△H2表示)。
(3)若容器容积不变,下列措施可提高反应Ⅰ中CO转化率的是 (选字母)。
a.充入CO,使体系总压强增大
b.将CH3OH(g)从体系中分离
e.充入He,使体系总压强增大
d.使用高效催化剂
(4)写出反应Ⅱ的化学平衡常数表达式:K= ;保持恒温恒容的条件下将反应Ⅱ的平衡体系各物质浓度均增加一倍,则化学平衡 (填“正向”、“逆向”或“不”)移动,平衡常数K (填“变大”、“变小”或“不变”)。
(5)这两种合成甲醇的方法比较,原子利用率较高的是 (填“Ⅰ”或“Ⅱ”)。
在密闭容器中,有一定起始浓度的氙(Xe)和F2反应,可得到3种氟化物。各种生成物在平衡体系内的分压与反应温度的关系如右图所示(已知气体的分压之比等于物质的量之比)。
⑴ 420K时,发生反应的化学方程式为:
________________________________________,
若反应中消耗1 mol Xe,则转移电子______mol。
⑵ 600~800K时,会发生反应:
XeF6(g)  XeF4(g) + F2(g) , 其反应热
XeF4(g) + F2(g) , 其反应热
△H________0(填“>”、“=”或“<”),理由是__________________________________________。
⑶ 900K时,容器中存在的组分有。
25时,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因(用离子方程式表示);
(2)混合溶液中由水电离出的c(OH-)____0.1 mol·L-1 NaOH溶液中由水电离出的c(OH-);(填>、<、=)
(3)求出混合液中下列算式的精确计算结果(填具体数字):
c (Na+)-c (A-)=mol·L-1;
(4)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,
①试推断(NH4)2CO3溶液的pH7 (填>、<、=);
②将相同温度下相同浓度的四种盐溶液:
| A.NH4HCO3 | B.NH4A | C.(NH4)2SO4 | D.NH4Cl |
按pH由大到小的顺序排列(填序号)
现有反应:CO(g)+ H2O(g) CO2(g)+ H2(g) ;△H<0,在850℃时,平衡常数K=1。
CO2(g)+ H2(g) ;△H<0,在850℃时,平衡常数K=1。
(1)若升高温度到950℃时,达到平衡时K____1(填“大于”、“小于”或“等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入 1.0 mol CO、3.0molH2O、1.0mol CO2和 x molH2,则:
①当x=5.0时,上述平衡向_______(填正反应或逆反应)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是。
(3)在850℃时,若设x=5.0 mol和x=6.0mol,其它物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a _______ b(填“大小”、“小于”或“等于”)。
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下: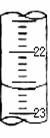
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗盐酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
试回答下列问题:
(1)锥形瓶中的溶液从 色变为 色时,停止滴定。
(2)上述操作步骤①中错误是 (请指出
具体错误)。由此造成的测定结果 (填偏高、偏低或无影响)。
(3)步骤②缺少的操作是
(4)某次滴定时的滴定管中的液面如图,其读数为 mL。若记录读数时,起始时俯视,终点时仰视,则所测溶液浓度会(填偏高、偏低或无影响)。
(5)根据下列数据:
| 滴定次数 |
待测液体积(mL) |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
20.00 |
0.50 |
25.40 |
| 第二次 |
20.00 |
4.00 |
29.10 |
请计算待测烧碱溶液的浓度为mol/L。
如下图所示的装置,C、D、E、F都是惰性电极。
将电源接通后,向乙中滴入酚酞试液.在F极附近显红色。试回答以下问题: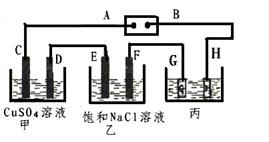
(1)电极A的名称是。
(2)甲装置中电解反应的总化学方程式是
。
(3)若用惰性电极电解饱和NaCl溶液一段时间,当阳极产生56mL(标准状况下)气体,电解后溶液体积为500mL时,求所得溶液在25℃时的pH =__________。
(4)欲用丙装置给铜镀银,G应该是(填“银”或“铜”),电镀液的主要成分是(填化学式)。