某研究性小组借助A-D的仪器装置完成有关实验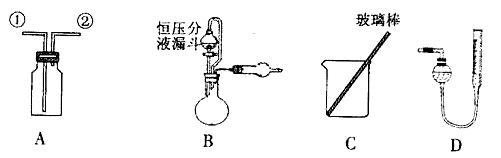
【实验一】收集NO气体。
(1)用装置A收集NO气体,正确的操作 (填序号)。
a.从①口进气,用排水法集气 b.从①口进气,用排气法集气
c.从②口进气,用排水法集气 d..从②口进气,用排气法集气
【实验二】为了探究镀锌薄铁板上的锌的质量分数w(Zn)和镀层厚度,查询得知锌易溶于碱:Zn+2NaOH=Na2ZnO2+H2↑据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1 g。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。
方案甲:通过测量试样与碱反应生成的氢气体积来实现探究目标。
(2)选用B和 (填仪器标号)两个装置进行实验。
(3)测得充分反应后生成氢气的体积为VL(标准状况),w(Zn) = 。
(4)若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将_____(填“偏大”、“偏小”或“无影响”)。
方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g 。
(5)w(Zn) 。
方案丙:通过称量试样与碱反应前后仪器、试样和试剂的总质量(其差值即为H2的质量)实现探究目标。实验同样使用仪器C。
(6)从实验误差角度分析,方案丙 方案乙(填“优于”、“劣于”或“等同于”)。
2006年世界锂离子电池总产量超过25亿只,锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的。因此锂离子电池回收具有重要意义,其中需要重点回收的是正极材料,其主要成分为钴酸锂(LiCoO2)、导电乙炔黑(一种炭黑)、铝箔以及有机粘接剂。某回收工艺流程如下: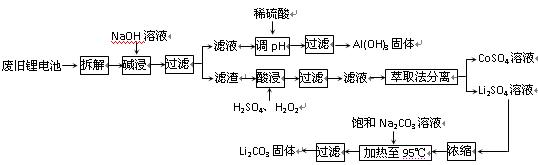
(1)上述工艺回收到的产物有。
(2)废旧电池可能由于放电不完全而残留有原子态的锂,为了安全对拆解环境的要求是_______________。
(3)碱浸时主要反应的离子方程式为_____________________。
(4)酸浸时反应的化学方程式为___________。如果用盐酸代替H2SO4和H2O2的混合液也能达到溶解的目的,但不利之处是_______________。
(5)生成Li2CO3的化学反应方程式为____________。已知Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应____________。
柴达木盆地以青藏高原“聚宝盆”之誉蜚声海内外,它有富足得令人惊讶的盐矿资源。液体矿床以钾矿为主,伴生着镁、溴等多种矿产。某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴(Br2),他们设计了如下流程: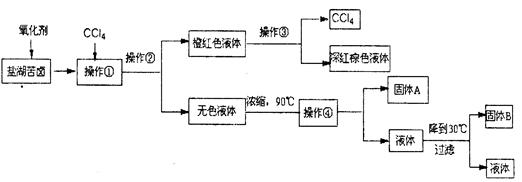
请根据以上流程,回答相关问题:
(1)操作②的所需的主要仪器是。
(2)参照右图溶解度曲线,得到的固体A的主要成分是(填化学式)。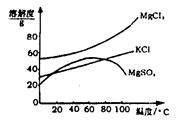
(3)同学甲提出一些新的方案,对上述操作②后无色溶液进行除杂提纯,其方案如下:
【有关资料】
| 化学式 |
BaCO3 |
BaSO4 |
Ca(OH)2 |
MgCO3 |
Mg(OH)2 |
| Ksp |
8.1×10一9 |
1.08×10一10 |
1.0×10一4 |
3.5×10一5 |
1.6×10一11 |
【设计除杂过程】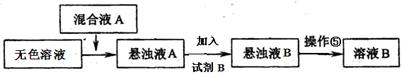
①已知试剂B是K2CO3溶液,则混合液A的主要成分是(填化学式)。
【获取纯净氯化钾】
②对溶液B加热并不断滴加l mol· L一1的盐酸溶液,同时用pH试纸检测溶液,直至pH=5时停止加盐酸,得到溶液C。该操作的目的是。
③将溶液C倒入蒸发皿中,加热蒸发并用玻璃棒不断搅拌,直到时(填现象),停止加热。
【问题讨论】
④进行操作⑤中控制溶液pH=12可确保Mg2+除尽,根据提供的数据计算,此时溶液B中Mg2+物质的量浓度为。
某学生利用以下装置探究喷泉实验。其中A、F分别为硫化氢和氯气的发生装置,C为纯净干燥的氯气与硫化氢反应的装置。
请回答下列问题:
(1)装置F中发生反应的化学方程式。
(2)装置A中的分液漏斗内液体a宜选用(选填以下选项的代号)
A.盐酸 B.浓硫酸 C.稀硫酸 D.稀硝酸
(3)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择。并将编号填入下列空格。
B__________、D__________、E__________(填编号)
(4)打开K1、K2,将常温压下的H2S、Cl2以体积比1:1充满烧瓶后,再关闭K1、K2,始终看不到烧瓶内产生“喷泉”现象,理由(用简要文字并配备化学方程式描述):。
(5)在操作(4)的基础上,引发喷泉操作方法是。
某化学小组用环己醇制备环己烯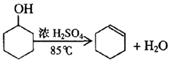
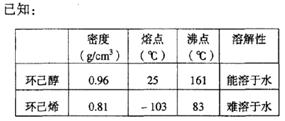
制得的环己烯粗品中含有环己醇和少量酸性杂质等。
(1)为制备环己烯精品:
①加入饱和食盐水,振荡、静置、分层,环己烯在层(填上或下),分液后用(填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按右图装置蒸馏,冷却水从 口进入。蒸馏时要加入生石灰,目的是。
口进入。蒸馏时要加入生石灰,目的是。
③收集产品时,控制的温度应在左右,实验制得的环己烯精品质量低于理论产量,可能的原因是()
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(2)在环己烯精品中滴加溴的CCl4溶液,发生反应的化学方程式。
某兴趣小组的学生根据活泼金属Mg与CO2发生反应,推测活泼金属钠也能与CO2发生反应,因此实验小组用下列装置进行“钠与二氧化碳反应”的实验探究(尾气处理装置已略去)。 已知:常温下,CO能使一些化合物中的金属离子还原。
已知:常温下,CO能使一些化合物中的金属离子还原。
例如:PdCl2+CO+H2O=Pd↓+CO2+2HCl
反应生成黑色的金属钯,此反应也可用来检测微量CO的存在。
请回答下列问题:
(1)通常实验室制取CO2气体的离子方程式是 ,为了使制气装置能“随开随用,随关随停”,上图A处应选用的装置是 (填写“Ⅰ”、“Ⅱ”或“Ⅲ”)。若要制取干燥、纯净的 CO2气体,装置B中应盛放的试剂是 溶液,装置C中应盛放的试剂是 。
CO2气体,装置B中应盛放的试剂是 溶液,装置C中应盛放的试剂是 。
(2)假设CO2气体为足量, 在实验过程中分别产生以下两种不同情况,请分析并回答问题:
在实验过程中分别产生以下两种不同情况,请分析并回答问题:
①装置F中溶液无明显变化,装置D中生成两种固体物质,取少量固体生成物与盐酸反应后,有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是 。
②装置F中有黑色沉淀生成,装置D中只生成一种固体物质,取少量该固体与盐酸反应后,也有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是 。
|
(3)请判断②中D装置生成固体的成分是钠的正盐还是酸式盐?请用文字简要说明理由。 。