下列叙述正确的是
| A.同族元素的氢化物的沸点随相对分子质量的增加而递增 |
| B.干冰晶体中的作用力只存在分子之间作用力 |
| C.碱金属的单质的沸点随相对原子质量的增加而递降 |
| D.向碳酸钠溶液中通入过量的二氧化碳,溶液会变浑浊 |
一种充电电池放电时的电极反应为H2+2OH--2e-=2H2O;NiO(OH)+H2O+e-=Ni(OH)2+OH-
当为电池充电时,与外电源正极连接的电极上发生的反应是
| A.H2O的还原 | B.NiO(OH)的还原 | C.H2的氧化 | D.Ni(OH)2的氧化 |
用石墨作电极电解CuSO4溶液。通电一段时间后,欲使电解质溶液恢复到起始状态,应向溶液中加入适量的
| A.CuSO4 | B.CuO | C.H2O | D.CuSO4·H2O |
已知温度T时水的离子积常数为KW=c(H+)•c(OH-),该温度下,将浓度为a mol·L-1的一元酸HA与b mol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
| A.a=b |
| B.混合溶液的PH=7 |
C.混合溶液中,c(H+)=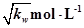 |
| D.混合溶液中,c(H+)+ c(B+)= c(OH-)+ c(A-) |
在容积可变的密闭容器中,2molN2和8molH2在一定条件下发生反应,达到平衡时,H2的转化率为25%,则平衡时氮气的转化率近于
| A.20% | B.25% | C.33% | D.35% |
已知:①2Zn(s)+O2(g)=2ZnO(s);△H=-701.0kJ·mol-1 ②2Hg(l)+O2(g)=2HgO(s);△H=-181.6kJ·mol-1则反应Zn(s)+ HgO(s)=ZnO(s)+ Hg(l)的△H为
| A.+519.4kJ·mol-1 | B.+259.7 kJ·mol-1 |
| C.-519.4kJ·mol-1 | D.-259.7kJ·mol-1 |