(12分)已知2A2(g)+B2(g) 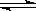 2C3(g);△H=-Q1 kJ/mol(Q1>0),在一个有催化剂的固定
2C3(g);△H=-Q1 kJ/mol(Q1>0),在一个有催化剂的固定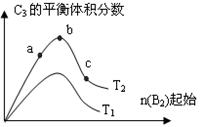
容积的容器中加入2 molA2和1 molB2,在5 00℃时充分反应,达平衡后C3的浓度为
00℃时充分反应,达平衡后C3的浓度为
w mol/L,放出热量Q2 kJ。
(1)若在原来的容器中,只加入2mol C3,500℃时充分反应达平 衡后,吸收热量Q3
衡后,吸收热量Q3 kJ,C3浓度 (填>、=、<)w mol/L,Q1、Q2、Q3之间满足何种关系 (用代数式表示)。
kJ,C3浓度 (填>、=、<)w mol/L,Q1、Q2、Q3之间满足何种关系 (用代数式表示)。
(2)能说明该反应已经达到平衡状态的是 。
a.v(C3)=2 v (B2); b.容器内压强保持不变
c.v逆(A2)=2 v正(B2) d.容器内的密度保持不变
(3)改变某一条件,得到如图的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是 ;
A.反应速率c>b>a
B.达到平衡时A2的转化率大小为:b>a>c
C.T2>T1
D.b点时,平衡体系中A、B原子数之比接近2∶1
(4)若将上述容器改为恒压容 器(反应前体积相同),起始时加入2 molA2和l molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2 Q4 ( 填 > 、 = 、 < ),理由是 。
器(反应前体积相同),起始时加入2 molA2和l molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2 Q4 ( 填 > 、 = 、 < ),理由是 。
下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。
|
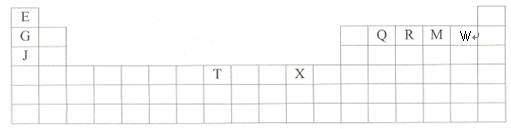
下列五种物质中,①H2O ②CO2③Na2O2 ④NaOH ⑤NaBr,只存在共价键的是__________,只存在离子键的是__________,既存在离子键又存在共价键的是_________,含有极性键的是__________,是非极性分子的是________。(填编号)下
(2分)已知元素电负性的差值大于1.7时,原子间形成离子键,小于1.7时,原子间形成共价键,请指出下列原子之间形成的化学键是离子键还是共价键。
Be(1.5)和F(4.0):____________,Si(1.8)和Cl(3.0):____________。
在一密闭容器中反应2SO2+O2 2SO3经5秒后,SO3的浓度增加了0.4mol·L-1,则在这段时间内用O2表示的反应速率为mol·L-1·s-1。
2SO3经5秒后,SO3的浓度增加了0.4mol·L-1,则在这段时间内用O2表示的反应速率为mol·L-1·s-1。
已知A、B、C、D、E、F是短周期中的6种非金属元素,它们的原子序数依次增大。A元素是周期表中半径最小的元素, B原子的最外层上有4个电子;C与D在周期表中处于相邻的位置,D的阴离子和E的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体Y;F的L层电子数等于K、M两个电子层上电子数之和
(1)请写出元素符号:
ABCDE F
(2)画出F的阴离子的结构示意图
(3)A单质和C单质在一定条件下反应生成化合物X,该反应的化学方程式为
向X的水溶液中滴入酚酞溶液,会观察到
(4)写出E在D的单质中点燃,生成固体Y化学方程式
(5)将12gB单质在足量的D单质中燃烧,所得气体通入1L 1mol/L NaOH溶液中,完全吸收后,溶液中大量存在的离子是。(相对原子质量:C—12)