常温下Ca(OH)2的Ksp=5.5×10-6,KspAg2SO4=" 1.2" ×10-5,KspAgCl=1.56×10-10,现有A、B、C、D、E、F六种化合物,已知它们的阳离子有K+、Ag+、Ca2+、Ba2+、Fe2+、Al3+ 阴离子有Cl-、OH-、HCO3-、NO3-、SO42-、CO32-,现将它们分别配成0.1mol·L-1的溶液,进行如下实验:
阴离子有Cl-、OH-、HCO3-、NO3-、SO42-、CO32-,现将它们分别配成0.1mol·L-1的溶液,进行如下实验:
① 测得溶液A、C、E呈碱性,且碱性为A>E>C;
② 向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
③向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
④在D溶液中滴加BaCl2溶液未看到白色沉淀
根据上述实验现象,回答下列问题:
(1)写出下列化合物的化学式:A C D E
(2)写出③中白色絮状沉淀变成红褐色过程中发生的化学反应方程式
(3)小骐同学欲将B、F混合,不小心将B、F倒入了稀盐酸中,马上看到有白色沉淀,你认为此白色沉淀中一定有 ,该同学还可以看到另一个现象,用离子方程式解释产生原因 。
有A、B、C、D、E、F六种元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D、F为常见金属元素。A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标况下的密度为0.759g/L,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族。均含D元素的乙(金属阳离子)、丙、丁微粒间的转化全为非氧化还原反应,均含F元素的乙(单质)、丙、丁微粒间的转化全为氧化还原反应。请回答下列问题: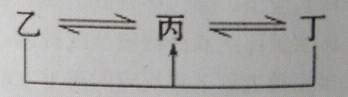
(1)单质B 的结构式: 。
(2)F元素周期表中的位置: 。
(3)均含有F元素的乙与丁在溶液中发生反应的离子方程式 。
均含有D元素的乙与丁在溶液中发生反应的离子方程式 。
(4)由A、C元素组成的化合物庚和A、E元素组成的化合物辛,相对分子质量均为34.其中庚的熔沸点比辛 (填“高”或“低”),原因是 。
铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等。回答下列问题:
(1)铅是碳的同族元素,比碳多4个电子层,铅在元素周期表的位置为 ,四氧化三铁可写成FeO·Fe2O3 的形式,如果将Pb3O4也写成相对应的形式应为: 。
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为: 。
PbO2可有PbO与次氯酸钠溶液反应制得,其反应的离子方程式为 。
(3)PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重4.0%(即 )的残留固体,若a点固体组成表示为PbO2或mPbO2 ·nPbO,计算x值和m:n , 。
)的残留固体,若a点固体组成表示为PbO2或mPbO2 ·nPbO,计算x值和m:n , 。
化合物H可用以下路线合成:

 已知:
已知:
回答下列问题:
(1)11.2L(标准状况)的烃A在氧气中充分燃烧可以生成88gCO2和45gH2O,且A分子结构中有3个甲基,则A的名称(系统命名)为 ;
(2)B和C均为一氯代烃,则反应(1)的反应类型为 ;
(3)在催化剂存在下1molF与2molH2反应,生成3—苯基—1—丙醇。F的结构简式 。
(4)反应②的化学方程式为 ;
(5)与G具有相同官能团的芳香类同分异构体共有 种(不包括G),写出其中任意两种_____________、___________。
X、Y、Z、M、R、W均为周期表中前四周期的元素。X的基态原子外围电子排布式为3s2;Y原子的L电子层的P能级上有一个空轨道;Z元素的基态原子最外层有3个未成对电子,次外层有2个电子;M 的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;R是海水中除氢、氧元素外含量最多的元素;W为过渡元素,它的基态原子外围电子排布成对电子数和未成对电子数相同且为最外层电子数的两倍。回答下列问题(相关回答均用元素符号表示):
(1)X的基态原子的外围电子排布式为,其基态原子有 种运动状态不同的电子;
(2)R的氢化物的稳定性比其上一周期同族元素氢化物的稳定性 (高或低)其原因是 ;
(3)ZM3﹣空间构型为 ,其中Z的杂化方式为 ;
(4)W与YM易形成配合物W(YM)5,在W(YM)5中W的化合价为 ;与YM分子互为等电子体的离子的化学式为 .
(5)W单质的晶体在不同温度下有两种原子堆积方式,晶胞分别如下图A、B所示: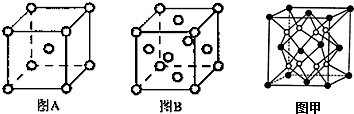
图B中原子堆积方式为 ,A、B中W原子的配位数之比为 .A、B晶胞的棱长分别为a cm和b cm,则A、B两种晶体的密度之比为 。
(6)X和W组成的合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图甲(黑球代表W,白球代表X).则该合金的化学式为 。
现代炼锌的方法可分为火法和湿法两大类,镉是生产硫酸锌的副产品,属于高毒性金属,试回答下列相关问题。
(1)火法炼锌是将闪锌矿(主要含ZnS)通过浮选、焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1373-1573K,使锌蒸馏出来。主要反应为:
2ZnS +3O2 2ZnO+2SO2;鼓风炉中:2C +O2
2ZnO+2SO2;鼓风炉中:2C +O2 2CO ZnO+CO
2CO ZnO+CO Zn + CO2
Zn + CO2
从火法炼锌蒸馏后的残渣中含多种金属单质及In2O3,可用硫酸提取铟,某研究机构对此研究数据如下。实验中涉及的酸度(每升溶液中含硫酸的质量)与铟的浸出率如下图1;硫酸溶液的体积与固体的体积比如图2
图1酸度对铟浸出率的影响图2液固比对铟浸出率的影响
①当酸度为196时,其物质的量浓度为 。
②从节约原料和浸出率考虑,适宜的酸度和液固比分别为:_______、_______。
(2)湿法炼锌的主要工艺流程为:
①从保护环境和充分利用原料角度,如何处理或利用烟气 。
②除去酸浸出液中的铁,可用H2O2氧化,再调节pH使之形成Fe(OH)3沉淀,写出H2O2氧化Fe2+的离子方程式 。
③酸浸出液还含有Cd2+,为了防止镉污染并回收镉,根据它们性质的差异,可用氢氧化钠溶液分离,已知Zn(OH)2和氢氧化铝一样也具有两性,试写出分离的离子方程式__________、__________。