粗食盐中除含有钙离子(CaCl2)、镁离子(MgCl2)、硫酸根离子等可溶性杂质外,还含有泥砂等不溶性杂质。我们食用的精盐是用粗食盐提纯而得到的。通过教材中“粗盐的提纯”及你做过的该实验回答下列问题。
(1)实验室进行NaCl溶液蒸发时,一般有以下操作过程 ①放置酒精灯 ;②固定铁圈位置 ;③放上蒸发皿(蒸发皿中盛有NaCl溶液);④加热搅拌; ⑤停止加热。其正确的操作顺序为 。
何时停止加热 。
(2)如何运用最简方法检验溶液中有无SO42-离子,所用试剂 。如何检验SO42-离子是否除净简单操作为 。
(3)粗食盐中除去钙离子所用试剂为 。化学反应方程式
(4)粗食盐中除去镁离子所用试剂为 。化学反应方程式
对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。若25℃时有HA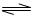 H++A―,则该弱酸的电离平衡常数的表达式为K=__________。下表是几种常见弱酸的电离平衡常数(25℃)。
H++A―,则该弱酸的电离平衡常数的表达式为K=__________。下表是几种常见弱酸的电离平衡常数(25℃)。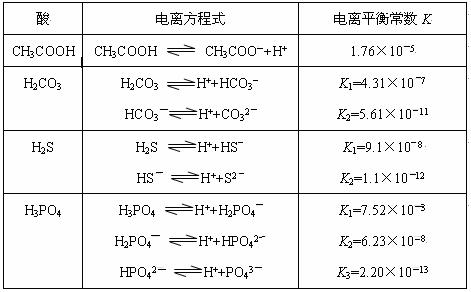
请回答下列各题:
(1)K只与温度有关,当温度升高时,K值______(填“增大”、“减小”或“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?_______________。
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是_____________,最弱的是_____________。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律是K1:K2:K3≈1:10―5:10―10,产生此规律的原因是:________________________。
红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)
据图回答下列问题
(1)P和Cl2反应生成PCl3的热化学方程式;
(2)PCl5分解生成PCl3和Cl2的热化学方程式;
上述分解反是一个可逆反应,温度T1时,在密闭容器中加入0.8mol PCl5,反应达到平衡时还剩余0.6mol PCl5,其分解率α1等于;若反应温度由T1升高到T2,平衡时PCl5分解率α2,α2α1(填“大于”,“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是;
(4)P和Cl2分两步反应生成1mol PCl5的△H3=;P和Cl2一步反应生成1mol PCl5的△H4△H3 (填“大于”、“小于”或“等于”),原因是。
现有以下物质:①NaCl晶体, ②液态SO3, ③液态醋酸, ④汞,
⑤BaSO4固体,⑥蔗糖(C12H22O11),⑦酒精(C2H5OH),⑧熔融KNO3
请回答下列问题(填序号):
(1)以上物质中能导电的是;
(2)以上物质中属于电解质的是 ;
(3))以上物质中属于非电解质的是;
(4)以上物质中属于弱电解质的是;
以对甲酚(A)为起始原料,通过一系列反应合成有机物E的路线如下: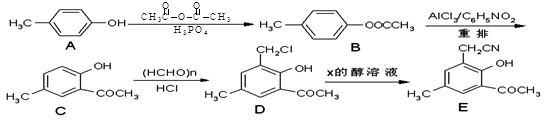
(1)A→B的反应类型为 。
(2)C的核磁共振氢谱有 个峰。
(3)D→E发生的取代反应中还生成了NaCl,则X的化学式为 。
(4)写出同时满足下列条件的D的同分异构体的结构简式: (任写一种)。
①苯的衍生物,苯环上有四个取代基且苯环上的一取代产物只有一种
②与Na2CO3溶液反应放出气体
(5)已知:R-CN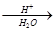 R-COOH,E在酸性条件下水解后的产物在一定条件下可生成F(C11H10O3)。写出F的结构简式: 。
R-COOH,E在酸性条件下水解后的产物在一定条件下可生成F(C11H10O3)。写出F的结构简式: 。
(6)利用合成E路线中的有关信息,写出以对甲酚、乙醇为主要原料制备 的合成路线流程图。
的合成路线流程图。
流程图示例如下: CH3CH2OH
CH3CH2OH  H2C=CH2 BrH2C-CH2Br
H2C=CH2 BrH2C-CH2Br
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。已知:
CH4(g)+H2O(g) ===CO(g)+3H2(g) ΔH=+206.2 kJ/mol
CH4(g)+CO2(g) ===2CO(g)+2H2(g) ΔH=+247.4 kJ/mol
CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为。
(2)硫铁矿(FeS2)燃烧产生的SO2通过下列碘循环工艺过程既能制H2SO4,又能制H2。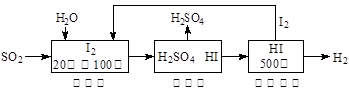
已知1g FeS2完全燃烧放出7.1 kJ热量,FeS2燃烧反应的热化学方程式为。
该循环工艺过程的总反应方程式为。
(3)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图见图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为。
(4)用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池。电池充放电时的总反应为:
NiO(OH)+MH Ni(OH)2+M
Ni(OH)2+M
①电池放电时,正极的电极反应式为。
②充电完成时,Ni(OH)2全部转化为NiO(OH)。若继续充电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电极反应式为。
(5)Mg2Cu是一种储氢合金。350℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。Mg2Cu与H2反应的化学方程式为。