Ⅰ.甲、乙、丙、丁、戊具有如图所示的结构或结构单元,图中四面体外可能有的部分未画出,只有实线表示共价键,X、Y可同可不同。
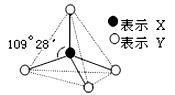
已知:甲、乙晶体类型相同,单质甲能与乙发生置换反应,丙、丁、己三种粒子均含有等量的总电子数,其中丙、己是同一类晶体中的分子,己在常温下呈液态,能产生两种10电子的离子,丁是阳离子且与丙符合"等电子原理"(具有相同电子数和原子数的分子或离子互称为等电子体),戊通常为气体与丙结构相似,但分子中多了24个价电子。
(1)写出液态己产生两种等电子粒子的电离方程式: 。
(2)X、Y原子的最外层都满足8电子的分子是 (填字母代号)
A.甲 B.乙 C.丙 D.戊 E.己
(3)写出甲与乙发生置换反应的反应方程式: 。
(4)丙是目前重要的能源之一。
①丙和己在催化、加热条件下得到可燃性的两种气体,其反应的化学方程式是: 。
②现代高能电池中,常用丙作燃料电池的原料,在碱性介质(KOH溶液)的情况下,其正极反应的电极方程式为 。
(5)请写出一种与戊符合"等电子原理"的离子 。
Ⅱ.A 、B 、C 、D 、E 五种短周期元素,原子序数依次增大.A、D同主族,A 与B 、C 分别构成电子数相等的化合物w、k,且w是一种能产生温室效应的气体;D 元素最外层电子数是次外层电子数的3 倍;A 、B 、C 、D 可形成化合物x;A 、D 、E 可形成化合物y;A 、C 、D 可形成化合物z.x、y、z 均为阳离子和阴离子个数比是1 : 1 的离子化合物.回答下列问题:
(1)y的电子式为_________________;w属于______ (填"极性"或"非极性)分子;
(2)与E 同主族且为第七周期的元素原子序数为_________________;
(3)在同主族氢化物的性质递变中,k 的沸点反常,这可以用__________来解释(填字母序号);
A.共价健 B.离子键 C.氢键 D.范德瓦耳斯力
(4)常温下,x 与y以物质的量之比1 : 2 反应后所得溶液显_______(填"酸"、"碱"或"中")性,由产物分析,原因是_______(用离子方程式表示);
(5)由k与D 的单质、KOH 溶液构成原电池,负极会产生C 的单质。则其负极反应为_____________;一段时间后,溶液pH__________(填"增大"、"减小"或"不变" )。
有难溶于水的粉末状固体样品,可能含Al、Fe2O3、Cu2O、SiO2、Fe3O4中的一种或几种。研究小组通过实验确定样品的成分。
查阅资料知:Cu2O + 2H+ =" Cu" + Cu2+ + H2O;
部分氢氧化物在溶液中沉淀的pH见下表:
| 物质 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
| 开始沉淀的pH |
1.8 |
6.3 |
5.2 |
| 完全沉淀的pH |
3.0 |
8.3 |
6.7 |
注:金属离子的起始浓度为0.1 mol·L-1实验步骤:
Ⅰ.取一定量样品于烧杯中,加足量NaOH溶液,有气体产生,过滤得固体A和无色溶液B;
Ⅱ.向B中加入稀硫酸,出现白色沉淀,继续滴加稀硫酸至过量,白色沉淀完全溶解;
Ⅲ.向A中加入足量稀硫酸并微热,固体完全溶解,得溶液C;
Ⅳ.向C中加入NaClO,调节溶液的pH至4~5,产生红褐色沉淀,过滤得到蓝绿色溶液D;
Ⅴ.向D中加入NaOH,调节溶液的pH到7~8,产生蓝色絮状沉淀。
请回答下列问题。
(1)Ⅰ中产生气体的离子方程式为。
(2)由Ⅰ、Ⅱ知,原样品中一定不存在的物质是。
(3)溶液C中除H+、Cu2+外一定还含有另一种阳离子;为验证溶液C中存在该阳离子,可选用的试剂及对应的现象是。
(4)Ⅳ中加NaClO的目的是。
(5)将Ⅳ中得到的溶液D电解,若电路中有0.1mol电子通过,则理论上阴极质量增重g。
(6)由上述实验可以获得结论:原样品所有可能的成分组合为组合1:;组合2:
;……(用化学式表示)
铁单质及其化合物在生活、生产中应用广泛。请回答:
(1)钢铁在空气中发生吸氧腐蚀时,正极的电极反应是。
(2)硫酸铁可作絮凝剂,常用于净水,其原理是(用离子方程式表示)。在使用时发现硫酸铁不能将酸性废水中的悬浮物沉降除去,其原因是。
(3)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe3O4十4CO 3Fe+4CO2,若有1.5 mol Fe3O4参加反应,转移电子的物质的量是。
3Fe+4CO2,若有1.5 mol Fe3O4参加反应,转移电子的物质的量是。
“温室效应”是哥本哈根气候变化大会研究的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决“温室效应”的有效途径。
(1)下列措施中,有利于降低大气中CO2浓度的有(填字母)。
a.采用节能技术,减少化石燃料的用量 b.鼓励乘坐公交车出行,倡导低碳生活
c.利用太阳能、风能等新型能源替代化石燃料
(2)一种途径是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l)=C2H4(g)+3O2(g)△Hl="+1411.0" kJ/mol
2CO2(g)+3H2O(l)=C2H5OH(l)+3O2(g)△H2="+1366.8" kJ/mol
则由乙烯水化制乙醇的热化学方程式是。
(3)在一定条件下,6H2(g)+2CO2(g) CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。
根据上表中数据分析:
①温度一定时,提高氢碳比[n(H2)/n(CO2)],CO2的转化率(填“增大”“减小”或“不变”)。
②该反应的正反应为(填“吸”或“放”)热反应。
氨在国民经济中占有重要地位。
(1)NH3的电子式为
(2)实验室中制取氨气的化学方程式为,
(3)欲快速制取氨气,可将浓氨水滴入固体氢氧化钠中,其装置如下图,请结合化学用语从化学平衡的角度解释: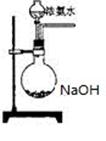
(4)将SO2气体通入氯化钡溶液,未见有沉淀生成,继续通入NH3,则出现白色沉淀,请写出反应的离子方程式;若将SO2气体通入酸化的硝酸钡溶液,也产生白色沉淀,用离子方程式加以说明
(5)氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。
肼——空气燃料电池是一种碱性电池,该电池放电时,负极的反应式。
(6)氮氧化物的排放会对空气造成污染,利用氧化法除去烟气中的氮氧化物。
首先向氮氧化物中补充氧气,然后将混合气体通入石灰乳中,使之转化为硝酸钙。
已知某氮氧化物由NO和NO2组成,且n(NO):n(NO2)=1:3.
写出氧化吸收法除去氮氧化物的化学方程式___________________
“温室效应”是哥本哈根气候变化大会研究的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决“温室效应”的有效途径。
(1)下列措施中,有利于降低大气中CO2浓度的有(填字母)。
a.采用节能技术,减少化石燃料的用量 b.鼓励乘坐公交车出行,倡导低碳生活
c.利用太阳能、风能等新型能源替代化石燃料
(2)一种途径是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l)=C2H4(g)+3O2(g)△Hl="+1411.0" kJ/mol
2CO2(g)+3H2O(l)=C2H5OH(l)+3O2(g)△H2="+1366.8" kJ/mol
则由乙烯水化制乙醇的热化学方程式是。
(3)在一定条件下,6H2(g)+2CO2(g) CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。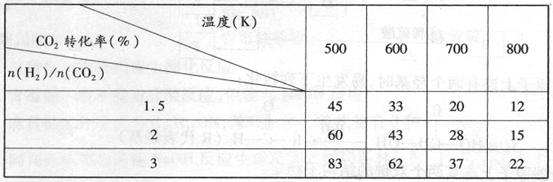
根据上表中数据分析:
①温度一定时,提高氢碳比[n(H2)/n(CO2)],CO2的转化率(填“增大”“减小”或“不变”)。
②该反应的正反应为(填“吸”或“放”)热反应。