某烃结构式如下: -C≡C-CH=CH-CH3,有关其结构说法正确的是( ):
-C≡C-CH=CH-CH3,有关其结构说法正确的是( ):
| A.所有原子可能在同一平面上 | B.所有原子可能在同一条直线上 |
| C.所有碳原子可能在同一平面上 | D.所有氢原子可能在同一平面上 |
T°C时,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。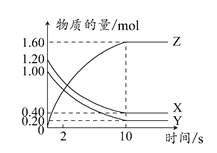
下列描述正确的是 ( )
| A.平衡时,X、Y的转化率相同 |
| B.达到平衡后,将容器体积压缩为1 L,平衡向正反应方向移动 |
C.T°C时,该反应的化学方程式为:X(g)+Y(g) 2Z(g),平衡常数K=40 2Z(g),平衡常数K=40 |
| D.T°C时,若起始时X为0.71 mol,Y为1.00 mol,则平衡时Y的转化率约为60% |
一定温度下,在一体积固定的密闭容器中加入2 mol X和1 mol Y,发生如下反应:2X(g)+Y(g) aZ(g)+W(g) ΔH=-Q kJ·mol-1(Q>0,a是正整数)。当反应达到平衡后,放出的热量为Q1 kJ,物质X的转化率为α;平衡后混合气体的平均相对分子质量与温度的关系如图所示,下列说法不正确的是( )
aZ(g)+W(g) ΔH=-Q kJ·mol-1(Q>0,a是正整数)。当反应达到平衡后,放出的热量为Q1 kJ,物质X的转化率为α;平衡后混合气体的平均相对分子质量与温度的关系如图所示,下列说法不正确的是( )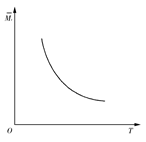
| A.温度升高,平衡常数K减小 |
| B.化学计量数a为1 |
| C.维持温度不变,若起始时向容器中加入a mol Z、1 mol W反应达到平衡后放出的热量为Q2 kJ,则Q1+Q2=Q且Q>Q1>Q2 |
| D.X的转化率α=Q1/Q |
在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应:H2(g)+Br2(g) 2HBr(g) ΔH<0。当温度分别为T1,T2,平衡时,H2的体积分数与Br2(g)的物质的量的变化关系如图所示。下列说法不正确的是 ( )
2HBr(g) ΔH<0。当温度分别为T1,T2,平衡时,H2的体积分数与Br2(g)的物质的量的变化关系如图所示。下列说法不正确的是 ( )
| A.由图可知:T1>T2 |
| B.a、b两点的反应速率:b>a |
| C.为了提高Br2(g)的转化率,可采取将HBr液化并及时移走的方法 |
| D.T1时,随着Br2(g)加入,平衡时HBr的体积分数不断增大 |
T ℃时,将6 mol CO2和8 mol H2充入2 L密闭容器中,发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示。图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化。下列说法正确的是( )
CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示。图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化。下列说法正确的是( )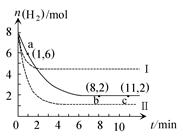
| A.反应开始至a点时v(H2)=1 mol·L-1·min-1 |
| B.若曲线Ⅰ对应的条件改变是升温,则该反应ΔH>0 |
| C.曲线Ⅱ对应的条件改变是降低压强 |
| D.T ℃时,该反应的化学平衡常数为0.125 |
当把晶体N2O4放入恒容的密闭容器中,待全部气化并建立N2O4 2NO2平衡后,保持温度不变,再放入N2O4晶体并全部气化,待反应达到新的平衡,新平衡与旧平衡比较,其值减小的是 ( )
2NO2平衡后,保持温度不变,再放入N2O4晶体并全部气化,待反应达到新的平衡,新平衡与旧平衡比较,其值减小的是 ( )
| A.c(NO2) | B.c(N2O4) | C. |
D.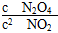 |