用18mol/L浓硫酸配制480ml 1.0mol/L稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积②量取一定体积的浓硫酸③稀释④转移、洗涤⑤定容、摇匀
回答下列问题
(1)所需浓硫酸的体积是 ,量取浓硫酸所用的量筒的规格是 。
A、10ml B、25ml C、50ml D、100ml
(2)实验需要的仪器除容量瓶、烧杯、量筒外,还需要 。
(3)第③步实验的操作是
。
(4)下列情况对所配制的稀硫酸浓度有何影响(用偏大、偏小、无影响填写)
A、所用的浓硫酸长时间放置在密封不好的容器中 。
B、容量瓶用蒸馏水洗涤后残留有少量的水 。
C、未冷却至室温即转移并定容
D、定容时俯视溶液的凹液面
(14分)氮、磷及其化合物在科研及生产中均有着重要的应用。
(1)某课外学习小组欲制备少量NO气体,写出铁粉与足量稀硝酸反应制备NO的离子方程式: 。
(2)LiFePO4是一种新型动力锂电池的电极材料。
①下图为某LiFePO4电池充、放电时正极局部放大示意图,写出该电池放电时正极反应方程式: 。
②将LiOH、FePO4·2H2O(米白色固体)与还原剂葡萄糖按一定计量数混合,在N2中高温焙烧可制得锂电池正极材料LiFePO4。焙烧过程中N2的作用是 ;实验室中以Fe3+为原料制得的FePO4·2H2O有时显红褐色,FePO4·2H2O中混有的杂质可能为 。
(3)磷及部分重要化合物的相互转化如图所示。
①步骤Ⅰ为白磷的工业生产方法之一,反应在1300℃的高温炉中进行,其中SiO2的作用是用于造渣(CaSiO3),焦炭的作用是 。
②不慎将白磷沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1mol CuSO4所能氧化的白磷的物质的量为 。
③步骤Ⅲ中,反应物的比例不同可获得不同的产物,除Ca3(PO4)2外可能的产物还有 。
[化学——物质结构与性质]
氢能是一种洁净的可再生能源,制备和储存氢气是氢能开发的两个关键环节。
Ⅰ.氢气的制取
(1)水是制取氢气的常见原料,下列说法正确的是 (填序号)。
A.H3O+的空间构型为三角锥形
B.水的沸点比硫化氢高
C.冰晶体中,1 mol水分子可形成4 mol氢键
(2)科研人员研究出以钛酸锶为电极的光化学电池,用紫外线照射钛酸锶电极,使水分解产生氢气。已知钛酸锶晶胞结构如图,则其化学式为 。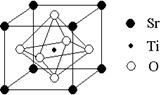
Ⅱ.氢气的存储
(3)Ti(BH4)2是一种储氢材料。
①Ti原子在基态时的核外电子排布式是 。
②Ti(BH4)2可由TiCl4和LiBH4反应制得,TiCl4熔点-25.0℃,沸点136.94℃,常温下是无色液体,则TiCl4晶体类型为 。
(4)最近尼赫鲁先进科学研究中心借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(结构如图所示),每个平面上下两侧最多可储存10个H2分子。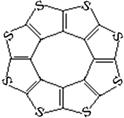
①元素电负性大小关系是:C S(填“>”、“=”或“<”)。
②分子中C原子的杂化轨道类型为 。
③有关键长数据如下:
| C—S |
C=S |
C16S8中碳硫键 |
|
| 键长/pm |
181 |
155 |
176 |
从表中数据可以看出,C16S8中碳硫键键长介于C—S与C=S之间,原因可能是: 。
④C16S8与H2微粒间的作用力是 。
NO和NO2是常见的氮氧化物,研究它们的综合利用有重要意义。
(1)氮氧化物产生的环境问题有 (填一种)。
(2)氧化—还原法消除氮氧化物的转化如下:
①反应Ⅰ为:NO+O3=NO2+O2,生成11.2 L O2(标准状况)时,转移电子的物质的量是 mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,反应的化学方程式是 。
(3)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:
NO2(g)+SO2(g) SO3(g)+NO(g) △H=-41.8 kJ·mol-1
SO3(g)+NO(g) △H=-41.8 kJ·mol-1
①已知:2SO2(g)+O2(g) 2SO3(g)△H=-196.6 kJ·mol-1
2SO3(g)△H=-196.6 kJ·mol-1
写出NO和O2反应生成NO2的热化学方程式 。
②一定温度下,向2 L恒容密闭容器中充入NO2和SO2各1 mol,5min达到平衡,此时容器中NO 和NO2的浓度之比为3∶1,则NO2的平衡转化率是 。
③上述反应达平衡后,其它条件不变时,再往容器中同时充入
NO2、SO2、SO3、NO各1mol,平衡 (填序号)。
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
(4)某化学兴趣小组构想将NO转化为HNO3,装置如图,电极为多孔惰性材料。则负极的电极反应式是 。
【化学—物质结构与性质】
氧元素在地壳中含量最多,含氧元素的物质种类也多如O2、H2O、H2O2等
I、(1)基态氧原子核外电子占有的轨道数 个。
II、化学反应A:Na2O2+H2O=2NaOH+H2O2B:NH3+H2O=NH3·H2O
(2)反应A过程中断裂的化学键类型有 。
a.离子键b.共价键c.σ键d.π键
(3)写出反应B中NH3的分子结构式 。
III、有一种氧单质O4其结构模型如图所示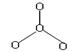
构型为平面正三角形,其物质的能量比O2高得多。
(4)中心氧原子杂化轨道类型是 。
(5)固体晶体类型属于 晶体。
(6)1molO22+含π键数目 。
【改编】研究NO2 、SO2 、CO等大气污染气体的处理具有重要意义,完成下列问题:
I.已知:2SO2(g) + O2(g) 2SO3(g)ΔH1= —196.6 kJ·mol―1
2SO3(g)ΔH1= —196.6 kJ·mol―1
2NO(g) + O2(g) 2NO2(g)ΔH2= —113.0 kJ·mol―1
2NO2(g)ΔH2= —113.0 kJ·mol―1
(1)反应NO2(g) + SO2(g) SO3(g) + NO(g) 的ΔH= 。
SO3(g) + NO(g) 的ΔH= 。
(2)硫酸工业尾气中的SO2可利用氨水吸收,写出该反应的方程式____________________。
II.汽车尾气是城市空气污染的一个重要因素,常用以下反应净化汽车尾气:
2NO(g)+2CO(g) 2CO2(g)+N2(g)
2CO2(g)+N2(g)
在某温度T1℃下,2L密闭容器中充入NO 、CO各0.4mol,测得不同时间的NO和CO物质的量如下表:
| 时间(s) |
0 |
2 |
4 |
6 |
8 |
10 |
| n(NO)(mol) |
0.4 |
0.32 |
0.26 |
0.22 |
0.20 |
0.20 |
(3)反应在4s内的平均速率为v(CO)= mol·L-1·s-1
(4)上述反应达到平衡后,继续加入NO 、CO、CO2各0.2mol和N2 mol时,平衡不移动。
(5)在上述条件下该反应能够自发进行,如果把温度从T1℃升高到T2℃,平衡常数K将 (填写“变大”、“变小”、“不变”)。
III.一种CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似燃料电池,其中的固体电解质是Y2O3-Na2O,O2ˉ可以在其中自由移动,
(6)O2ˉ移向电池 极(填“正”或“负”),
(7)负极的反应式为 。