(1)0.1mol/L Na2CO3溶液呈 (填“酸性”、“碱性”或“中性”),其原因是 (用离子方程式表示)
(2)氢氧燃料电池是利用氢能的一种重要方式。请写出氢氧燃料电池(电解质溶液为KOH溶液)的负极的电极反应式 ;
(3)某温度下的水溶液中,c(H+)=10-xmol/L,c(OH-)=10-y mol/L。x与y的关系如图所示,该温度下水的离子积为 ;该温度下0.01 mol/L NaOH溶液的pH为 。
(4)如图装置,已知两电极上发生的电极反应分别为:
a极:Cu2++2e-= Cu b极:Fe-2e-= Fe2+
该装置中原电解质溶液一定含有 ;(填序号)
| A.Cu2+ | B.Na+ | C.Fe2+ | D.Ag+ |

(5)硫酸钡在水中存在沉淀溶解平衡:BaSO4(s) Ba2+ (aq)+ SO42-(aq) 25℃时,BaSO4的Ksp=1.1×l0—10,在0.1 mol·L一1硫酸溶液中,钡离子的浓度最大可达到 mol·L一1。
Ba2+ (aq)+ SO42-(aq) 25℃时,BaSO4的Ksp=1.1×l0—10,在0.1 mol·L一1硫酸溶液中,钡离子的浓度最大可达到 mol·L一1。
已知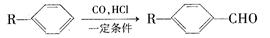
为合成某种液晶材料的中间体M,有人提出如下不同的合成路径: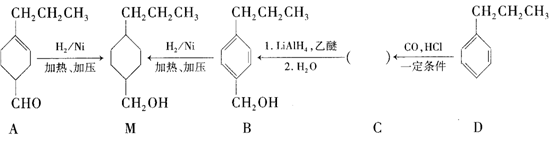
(1)常温下,下列物质能与A发生反应的有________(填序号)。
a.苯 b.Br2/CCl4 c.乙酸乙酯 d.KMnO4/H+溶液
(2)M中官能团的名称是_______,由C→B的反应类型为__________。
(3)由A催化加氢生成M的过程中,可能有中间产物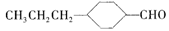 和______(写结构简式)生成。
和______(写结构简式)生成。
(4)检验B中是否含有C可选用的试剂是___________(任写一种名称)。
(5)物质B也可以由C10H13Cl与NaOH水溶液共热生成,C10H13Cl的结构简式为_______。
(6)C的一种同分异构体E具有如下特点:
a.分子中含—OCH2CH3 b.苯环上只有两种化学环境不同的氢原子
写出E在一定条件下发生加聚反应的化学方程式:____________。
近年来我国的航天事业取得了巨大的成就,在航天发射时,常用肼(N2H4)及其衍生物作火箭推进剂。
(1)液态肼作火箭燃料时,与液态N2O4混合发生氧化还原反应,已知每克肼充分反应后生成氮气和气态水放出热量为a KJ,试写出该反应的热化学方程式;
(2)在实验室中,用N2H4·H2O与NaOH颗粒一起蒸馏,收集114~116℃的馏分即为无水肼。在蒸馏过程中需要的仪器有酒精灯、锥形瓶、冷凝管、牛角管(接液管)、蒸馏烧瓶,除上述必需的仪器外,还缺少的玻璃仪器是;
(3)肼能使锅炉内壁的铁锈(主要成分Fe2O3)变成磁性氧化铁(Fe3O4)层,可减缓锅炉锈蚀。若反应过程中肼转化为氮气,则每生成1molFe3O4,需要消耗肼的质量为g。
(4)磁性氧化铁(Fe3O4)的组成可写成FeO·Fe2O3。某化学实验小组通过实验来探究一黑色粉末是否由Fe3O4、CuO组成(不含有其它黑色物质)。探究过程如下:
提出假设:假设1. 黑色粉末是CuO;假设2. 黑色粉末是Fe3O4;
假设3.。
设计探究实验:
取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂。
①若溶液显蓝色,则假设1成立。
②若所得溶液显血红色,则假设成立。
③为进一步探究,继续向②所得溶液加入足量铁粉,若有红色固体析出的现象,则假设3成立。
有另一小组同学提出,若混合物中CuO含量较少,可能加入铁粉后实验现象不明显。
查阅资料:Cu2+与足量氨水反应生成深蓝色溶液,Cu2++4NH3·H2O=Cu(NH3)42++4H2O。
④为探究是假设2还是假设3成立,另取少量粉末加稀硫酸充分溶解后,再加入足量氨水,若假设2成立,则产生现象;若假设3成立,则产生红褐色沉淀,同时溶液呈深蓝色。
工业制硫酸生产流程如下图: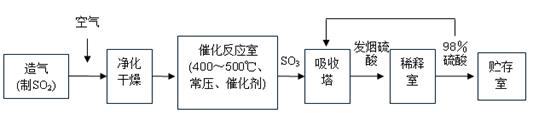
已知:在450℃,常压下,2SO2(g)+O2(g) 2SO3(g),ΔH=-196 kJ·mol-1。请回答:
2SO3(g),ΔH=-196 kJ·mol-1。请回答:
(1)在催化反应室,下列措施中有利于提高SO2平衡转化率的有;
A.升高温度 B.减少压强 C.不断补充空气 D.及时分离出SO3
(2)在生产中,为提高催化剂效率可采取的措施为;
A.净化气体 B.控制温度在400~500℃
C.增大催化剂与反应气体的接触面积 D.不断补充空气
(3)在450℃、常压和钒催化条件下向一密闭容器中充入2molSO2和1molO2,充分反应后,放出的热量______(填“<”、“>”或“=”)196kJ。
(4)经检测生产硫酸的原料气成分(体积分数)为SO27%、O211%、N282%。在500℃,0.1MPa条件下,现有100L原料气参加反应,达到平衡时,气体的总体积变为97.2L,则SO2的转化率为。
如下表所示为自然界中的多种铜矿石的主要成分:
| 矿石名称 |
黄铜矿 |
斑铜矿 |
辉铜矿 |
孔雀石 |
| 主要成分 |
CuFeS2 |
Cu5FeS4 |
Cu2S |
CuCO3·Cu(OH)2 |
请回答:
(1)上表所列铜化合物中,铜的质量百分含量最高的是 (填化学式);
(2)工业上以黄铜矿为原料。采用火法溶炼工艺生产铜。该工艺的中间过程包含反应:
2Cu2O+Cu2S 6Cu+SO2↑,则该反应的氧化剂与还原剂的物质的量之比是 ;
6Cu+SO2↑,则该反应的氧化剂与还原剂的物质的量之比是 ;
(3)火法溶炼工艺生产铜的尾气直接排放到大气中造成环境污染的后果是 ;处理该尾气可得到有价值的化学品,写出其中一种酸和一种盐的名称或化学式 、 。
(4)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是 (填字母)。
| 选项 |
陈述Ⅰ |
陈述Ⅱ |
判断 |
| A |
铜绿的主成分是碱式碱酸铜 |
可用稀盐酸除铜器表面的铜绿 |
Ⅰ对;Ⅱ对;有 |
| B |
铜表易形成致密的氧化膜 |
铜容器可以盛放浓硫酸 |
Ⅰ对;Ⅱ对;有 |
| C |
铁比铜活泼 |
铆在铜板上的铁钉在潮湿空气中不易生锈 |
Ⅰ对;Ⅱ对;有 |
| D |
蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化 |
硫酸铜溶液可用作游泳池的消毒剂 |
Ⅰ错;Ⅱ对;无 |
元素A、B、C、D均为短周期元素,请根据表中信息回答下列问题。
| 元素 |
A |
B |
C |
D |
| 性质 结构 信息 |
单质制成的高压灯,发出的黄光透雾力强、射程远。 |
工业上通过分离液态空气获得其单质。原子的最外层未达到稳定结构。 |
单质常温、常压下是气体,原子的M层有一个未成对的p电子。 |
+3价阳离子的核外电子排布与氖原子相同。 |
(1)上表中与A属于同一周期的元素是(填元素符号),D离子的核外电子排布式为;
(2)A和B形成的化合物晶体类型为;C单质与氢氧化钠溶液反应的离子方程式为;
(3)对元素B的相关描述正确的是。
a.B元素的最高正价可能为+6 b.常温、常压下B单质难溶于水
c.B单质分子中含有18个电子 d.在一定条件下B单质能与镁条反应