下列叙述正确的是( )
| A.常见金属铁和铝在工业上是由热还原法制得的 |
| B.二氧化硅晶体被广泛用于制作太阳能电池和光导纤维 |
| C.玛瑙和餐桌上的瓷盘都是硅酸盐制品 |
| D.钢材和硬币都是合金,若改变这些合金的原料配比会改变这些合金的性能 |
下列化学反应的离子方程式正确的是()
| A.用小苏打治疗胃酸过多:HCO3- + H+ ="=" CO2↑ + H2O |
| B.往碳酸镁中滴加稀盐酸:CO32- + 2H+ ="=" CO2↑+ H2O |
| C.往氨水中滴加氯化铝溶液:Al3+ + 4OH- ="=" AlO2- +2H2O |
D.氢氧化钡溶液与稀硫酸反应:Ba2++ SO42- + H+ + OH- ="=" BaSO4↓ + H2O + H2O |
下列物质不属于“城市空气质量日报” 报
报 道的是()
道的是()
| A.二氧化硫 | B.氮氧化物 | C.二氧化碳 | D.悬浮颗粒 |
从海水中提取镁,没有涉及到的化学反应是()
| A.Mg2+ + 2OH- ="=" Mg(OH)2↓ | B.Mg(OH)2 + 2HCl ="=" MgCl2 + H2O |
C.Mg(OH)2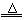 MgO + H2O MgO + H2O |
D.MgCl2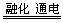 Mg + Cl2↑ Mg + Cl2↑ |
分离下列各组混合物时,可以按溶解、过滤、蒸发的顺序操作的是()
| A.氢氧化钠和氯化钠 | B.氧化铜和铜粉 |
| C.碳酸钠和碳酸钙 | D.氯化钡和硝酸钡 |
镍镉电池在通讯、交通及日常生活中有着广泛的应用,其工作原理可以表示为:Cd+2NiO(OH)+2H2O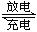 2Ni(OH)2+Cd(OH)2以下说法中正确的是:()
2Ni(OH)2+Cd(OH)2以下说法中正确的是:()
| A.以上反应是可逆反应 |
| B.放电时,镉为正极 |
| C.充电时电池上标有“+”号的电极连接电源负极 |
D.以镍镉电池为电源,电解Na2CO3溶液,当收集到气体的总体积为33.6L (标况下)时,电池中转移了2mol电子 (标况下)时,电池中转移了2mol电子 |