现有硫酸和硫酸钠的混合溶液200 mL,其中硫酸的浓度为0.4 mol·L-1,硫酸钠的浓度为0.5mol·L-1。若使硫酸和硫酸钠的浓度分别为2mol·L-1。和0.2 mol·L-1,现有98%的密度为1.84g·cm-3。的浓硫酸和蒸馏水,配制完成后能得到多少毫升新的混合液?需98%的浓硫酸多少毫升?
实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: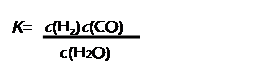
它所对应的化学反应为:
(2)已知在一定温度下,
C(s)+CO2(g) 2CO(g)平衡常数K1;
2CO(g)平衡常数K1;
CO(g)+H2O(g  H2(g)+CO2(g)平衡常数K2;
H2(g)+CO2(g)平衡常数K2;
C(s)+H2O(g) CO(g)+H2(g)平衡常数K3;
CO(g)+H2(g)平衡常数K3;
则K1、K2、K3之间的关系是:。
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)  H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
| 温度/℃ |
400 |
500 |
800 |
| 平衡常数K |
9.94 |
9 |
1 |
该反应的正反应方向是反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化率为:。
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。对反应N2O4(g)  2NO2(g) △H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 。
2NO2(g) △H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 。
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
E.A、C两点的化学平衡常数:A>C
(5)0.2mol/L的NaOH与0.4mol/L的硝酸铵溶液等体积混合后,溶液中各离子的物质的量浓度从大到小的顺序是。
(6)工业上用Na2SO3吸收尾气中的SO2,再用右图装置电解(惰性电极)NaHSO3制取H2SO4,阳极电极反应式,阳极区逸出气体的成分为__________(填化学式)。
利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺如下:
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4 mol·L―1的浓硫酸配制250 mL 4.8 mol·L―1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和胶头滴管外,还需。
(2)酸浸时,为了提高浸取率可采取的措施有、
。(写出两个措施)
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72―,写出此反应的离子方程式:
。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 |
Fe3+ |
Mg2+ |
Al3+ |
Cr3+ |
| 开始沉淀时的pH |
2.7 |
—— |
—— |
—— |
| 沉淀完全时的pH |
3.7 |
11.1 |
8 |
9(>9溶解) |
加入NaOH溶液使溶液呈碱性,Cr2O72―转化为CrO42―。滤液Ⅱ中阳离子主要有;但溶液的pH不能超过8,其理由是。
(5)钠离子交换树脂的反应原理为:Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是。
(6)写出上述流程中用SO2进行还原的化学方程式。
如图所示,通电5 min后,第③极增重2.16 g,同时在A池中收集到标准状况下的气体224 mL,设A池中原混合液的体积为200 mL。
⑴电源F为____________极;第②极为__________极;B池为___________池;
⑵A池中第②极上的电极反应式为_____________________;
A池中第①极上产生气体体积为__________________ mL;(标准状况下)
(3) 通电前A池中原混合溶液Cu2+的浓度为;
(1)0.1mol/L Na2CO3溶液呈(填“酸性”、“碱性”或“中性”),其原因是(用离子方程式表示)
(2)氢氧燃料电池是利用氢能的一种重要方式。请写出氢氧燃料电池(电解质溶液为KOH溶液)的负极的电极反应式。
(3)某温度下的水溶液中,c(H+)=10-xmol/L,
c(OH-)=10-y mol/L。x与y的关系如右图所示: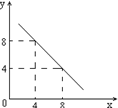
该温度下水的离子积为 ;该温度下0.01 mol/L NaOH溶液的pH为 。
(4)如右图装置,已知两电极上发生的电极反应分别为:a极:Cu2++2e-= Cu
b极:Fe-2e-= Fe2+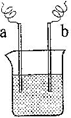
该装置中原电解质溶液一定含有(填序号)
| A.Cu2+ | B.Na+ | C.Fe2+ | D.Ag+ |
(5)硫酸钡在水中存在沉淀溶解平衡:BaSO4(s) Ba 2+ (aq)+ SO42-(aq) 25℃时,BaSO4的Ksp=1.1×l0—10,在0.1 mol·L一1硫酸溶液中,钡离子的浓度最大可达到mol·L一1
Ba 2+ (aq)+ SO42-(aq) 25℃时,BaSO4的Ksp=1.1×l0—10,在0.1 mol·L一1硫酸溶液中,钡离子的浓度最大可达到mol·L一1
铜是生命必需的元素,也是人类最早使用的金属之一,铜的生产和使用对国计民生各个方面产生了深远的影响。在化学反应中,铜元素可表现为0、+1、+2价。
(1)在西汉古籍中曾有记载:曾青得铁则化为铜,试写出该反应的化学方程式:________。
(2)铜器表面有时会生成铜绿[Cu2(OH)2CO3]这层铜绿可用化学方法除去。试写出除去铜绿而不损伤器物的反应的化学方程式:____________________________________。