实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: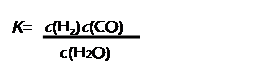
它所对应的化学反应为:
(2)已知在一定温度下,
C(s)+CO2(g) 2CO(g)平衡常数K1;
2CO(g)平衡常数K1;
CO(g)+H2O(g  H2(g)+CO2(g)平衡常数K2;
H2(g)+CO2(g)平衡常数K2;
C(s)+H2O(g) CO(g)+H2(g) 平衡常数K3;
CO(g)+H2(g) 平衡常数K3;
则K1、K2、K3之间的关系是: 。
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)  H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
| 温度/℃ |
400 |
500 |
800 |
| 平衡常数K |
9.94 |
9 |
1 |
该反应的正反应方向是 反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化率为: 。
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。对反应N2O4(g)  2NO2(g) △H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 。
2NO2(g) △H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 。
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
E.A、C两点的化学平衡常数:A>C
(5)0.2mol/L的NaOH与0.4mol/L的硝酸铵溶液等体积混合后,溶液中各离子的物质的量浓度从大到小的顺序是 。
(6)工业上用Na2SO3吸收尾气中的SO2,再用右图装置电解(惰性电极)NaHSO3制取H2SO4,阳极电极反应式 ,阳极区逸出气体的成分为 __________(填化学式)。
(16分)合理的处理C与N的化合物,减少对环境产生污染,是科学家研究的课题。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g) △H<0若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。
2CO2(g)+ N2(g) △H<0若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。
(2)在一定条件下,CH4和CO2以镍合金为催化剂,发生反应:CO2(g)+CH4(g)  2CO(g)+2H2(g),其平衡常数为K,在不同温度下,K 的值如下:
2CO(g)+2H2(g),其平衡常数为K,在不同温度下,K 的值如下:
①从上表可以推断:该反应的逆反应是 (填“吸”、“放”)热反应。
②同一条件下该反应正反应的平衡常数为K1,逆反应的表达式平衡常数为K2,K1与K2的关系式 。
(3)煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
2NO2(g) N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol
H2O(g) = H2O(l) △H=-44.0 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式: 。
(4)在一定条件下,可以用NH3处理NOx。已知NO与NH3发生反应生成N2和H2O,现有NO和NH3的混合物1mol,充分反应后得到的还原产物比氧化产物多1.4 g,则原反应混合物中NO的物质的量可能是_____________。
(5)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是_________。
②为了提高该反应中CH4的转化率,可以采取的措施是 。
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为 。
[化学——选修5:有机化学基础]丁苯酞(J)是治疗轻、中度急性脑缺血的药物,合成J的一种路线如下
②E的核磁共振氢谱只有一组峰;
③C能发生银镜反应;
④J是一种酯,分子中除苯环外还含有一个五元环。
回答下列问题:
(1)由A生成B的化学方程式为 ,其反应类型为 。
(2)D的化学名称是 。
(3)J的结构简式为 ,由D生成E的化学方程式为 。
(4)G的同分异构体中核磁共振氢谱有4组峰且能与 溶液发生显色反应的结构简式为 (写出一种即可)。
溶液发生显色反应的结构简式为 (写出一种即可)。
(5)由甲醛和化合物A经下列步骤可得到2一苯基乙醇。
反应条件1为 ;反应条件2所选择的试剂为 ;L的结构简式为 。
[化学——选修3:物质结构与性质]1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如 等。回答下列问题:
等。回答下列问题:
(1)某种金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于 (填“晶体”或“非晶体”)。
(2)基态铜原子有 个未成对电子,二价铜离子的电子排布式为 ,在CuS04溶液中滴入过量氨水,形成配合物的颜色为 。
(3)铜能与类卤素(SCN)2反应生成Cu(SCN)2,1 mol(SCN)2分子中含有共价键的数目为 ;类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N="C=S" )的沸点,其原因是 。
(4)ZnS的晶胞结构如图1所示,在ZnS晶胞中,S2-的配位数为 。
(5)铜与金形成的金属互化物结构如图2,其晶胞边长为a nm,该金属互化物的密度为 (用含“a、NA的代数式表示)g· 。
。
雾霾含有大量的污染物SO2、NO。工业上变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):

(1)装置Ⅰ的目的是 。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图所示。
①若是0.1molNaOH反应后的溶液,测得溶液的pH=4时,溶液中各离子浓度由大到小的顺序是 。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。
(3)写出装置Ⅱ中,酸性条件下反应的离子方程式 , 。
(4)装置Ⅲ中阴极反应方程式为 ;阳极使Ce4+再生,其原理如图所示。生成Ce4+从电解槽的 (填字母序号)口流出。
(5)若进入装置Ⅳ的溶液中的NO2-完全转化为NH4NO3, 反应中氧化剂与还原剂的物质的量之比为。
[化学——选修5:有机化学基础]高分子材料PET聚酯树脂和PMMA的合成路线如下:
已知:
Ⅰ.RCOOR′+ R′′18OH  RCO18O R′′+ R′OH(R、R′、R′′代表烃基)
RCO18O R′′+ R′OH(R、R′、R′′代表烃基)
Ⅱ.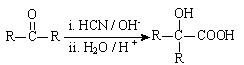 (R、R′代表烃基)
(R、R′代表烃基)
(1)①的反应类型是________。
(2)②的化学方程式为________。
(3)PMMA单体的官能团名称是________、________。
(4)F的核磁共振氢谱显示只有一组峰,⑤的化学方程式为________。
(5)G的结构简式为________。
(6)下列说法正确的是________(填字母序号)。
a.⑦为酯化反应
b.B和D互为同系物
c.D的沸点比同碳原子数的烷烃高
d.1 mol 与足量NaOH溶液反应时,最多消耗4 mol NaOH
(7)J的某种同分异构体与J具有相同官能团,且为顺式结构,其结构简式是________。
(8)写出由PET单体制备PET聚酯(化学式为C10nH8nO4n 或C10n+2H8n+6O4n+2)并生成B的化学方程式 。