(12分)前四周期元素X、Y、Z、W核电荷数依次增加,核电荷数之和为58;Y 原子的M层p轨道有3个未成对电子;Z与Y同周期,且在该周期中电负性最大;W原子的L层电子数与最外层电子数之比为4∶1,其d轨道中的电子数与最外层电子数之比为5∶2。
(1)X的元素符号为_______,Z元素位于周期表第_______周期第________族。
(2)Y与X形成共价化合物A,Z与X形成共价化合物B,A与B还原性较强的是________(写分子式)。
(3)Z的最高价氧化物的水化物的化学式为________________。
(4)12.4 g单质Y4与0.3 mol O2在一定条件下恰好完全反应生成0.1 mol化合物C,一个C分子中所含有的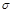 键数目为 。
键数目为 。
(5)含W元素的最高化合价的含氧酸根离子是___________,该含氧酸根离子在分析化学中有重要作用,请写出在酸性条件下该含氧酸根离子与Fe2+反应的离子方程式:
______________________________________________________________________。
.2009年10月16日第十一届全运会在济南举行,全运会使用的火炬的燃料是丙烷。
(1)已知11g丙烷完全燃烧生成CO2和液态水时放出的热量为555kJ,请写出丙烷燃烧热的热化学方程式
(2)某温度下,纯水中的c(H+)=2.0×10-7mol/L,若温度不变,滴入稀硫酸使c(H+)=5.0×10-6mol/L,则该溶液中由水电离出的c(OH-)为
.恒温恒容下,将2 mol A气体和2 mol B气体通入体积为2 L的密闭容器中发生如下反应:2A(g)+B(g) xC(g)+2D(s),2 min时反应达到平衡状态,此时剩余1.2 mol B,并测得C的浓度为1.2 mol·L-1。
xC(g)+2D(s),2 min时反应达到平衡状态,此时剩余1.2 mol B,并测得C的浓度为1.2 mol·L-1。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为______
(2)x=________。
(3)A的转化率为_____ ___。
(4)下列各项可作为该反应达到平衡状态的标志的是________。
| A.压强不再变化 |
| B.气体密度不再变化 |
| C.气体的平均相对分子质量不再变化 |
| D.A的消耗速率与B的消耗速率之比为2∶1 |
(18分)现有通式均为(CH2O)n的六种有机物,性质如下:
①A是无色有刺激性的气体,可发生银镜 反应
反应
②B、C、D的式量均为A 的2倍,E的式量的是A 的3倍,F的式量是A的6倍
③B、E的水溶液可使紫色石蕊试液变红,还可与乙醇在一定条件下酯化
④ E结构中含有—CH3,两分子E 可形成环状酯
⑤C不溶于水,D、F二种物质的水溶液均呈中性,C既能水解,又能发生银镜反应,D不能发生水解反应,却能发生银镜反应,还能与钠反应放出H2,F能发生银镜反应,淀粉水解可得F。
(1)请写出各物质的结构简式:
A_______ _B___________C ___________
_B___________C ___________
D_____________E___________ F_____________
(2)写出B 和 碳酸钠溶液反应的离子方程式
(3) 写出C在碱性条件下加热水解的化学方程式
(4)在右侧方框内写出两分子E所形成的环状酯的结构简式
回答问题:
(1)甲、乙两试管分别盛有5 mLFeCl3溶液和5 mLFeCl2溶液,各滴入几滴KSCN溶液。填写下表:
| 试样 |
滴入KSCN溶液后的现象 |
两试管里产生不同的现象有何用途 |
| 甲试管(FeCl3) |
||
| 乙试管(FeCl2) |
(2)在盛有3 mLFeCl3溶液的试管中加入少量铁粉,若充分反应后没有固体物剩余。该试管的溶液中存在什么金属阳离子?如何进一步得到肯定答案?
现有金属单质A、B和气体甲、乙、丙以及物质C、D、E、F,它们之间能发生如下反应。(图中有些反应的产物和反应条件没有标出)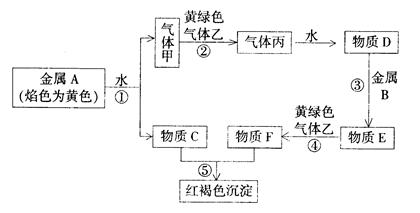
请回答下列问题:
(1)A的化学式为,丙的化学式为;
(2)写出下列反应的离子方程式:
①;④ ;⑤ 。
(3)写出C溶液与Al反应的化学方程式:
(4)将C溶液加到E溶液中,可以观察到的现象是: