(12分)X、Y、Z、W、Q、R六种短周期主族元素,原子序数依次增大,Z基态原子核外有三个未成对电子,Y、Z、W分别与X形成常见化合物的分子结构依次为正四面体、三角锥形和V形,Q的各级电离能如下表,W与R是同族元素。
| Q |
I1 |
I2 |
I3 |
I4 |
I5 |
… |
| 电离能(kJ/mol) |
496 |
4562 |
6912 |
9543 |
13353 |
… |
回答下列有关问题:
(1)W原子的价电子排布图为_______________________________。
(2)化合物Q2W2的电子式_________________,化合物XYZ的结构式________________。
(3)Y、Z、W分别与X形成常见化合物的沸点由高到低的顺序是____________________(用分子式表示)。
(4)RW3分子中的键角___________,W3分子的立体构型是_______________形。
(5)根据等电子原理,指出与YW2互为等电子体且含有Z原子的微粒有 、
(要求写一种分子和一种离子)。
从某铝镁合 金片上剪下一小块(质量为1.0g),立即投入到盛有10mL10mol/LNaOH溶液的小烧杯中。
金片上剪下一小块(质量为1.0g),立即投入到盛有10mL10mol/LNaOH溶液的小烧杯中。
(1)自反应开始到反应结束,从小烧杯中可观察到的主要现象。(请依次写出)
(2)开始时产生气泡的速率较慢的原因是。
后来的反应速率相当快的原因是。
(3)写出所形成的原电池的负极材料名称:
电 极反应式:
极反应式:
(4)欲利用该反应来测定合金中铝的含量,还应测定的数据。(请逐一写出)
工业上采用Fe、C为电极电解K2MnO4溶液制KMnO4.
(1)电解时,应以作阴极,电解过程中阴极附近溶液pH将会
(2)阳极反应式为(3)总电解反应式为
如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞液,在F极附近显红色。试回答以下问题: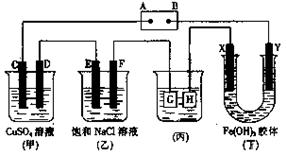
(1)电源A极的名称是。
(2)甲装置中电解反应的总化学方程式是_________________________。
(3)如果收集乙装置中产生的气体,两种气体的体积比是______________。
(4)欲用丙装置给铜镀银,G应该是_______,电镀液的主要成分是_________(填化学式)。
在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示,请回答: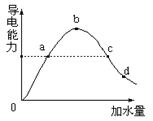
(1)加水前导电能力为零的理由是:
(2)a、b、c、d四点醋酸的电离度大小顺序是
(3)a、b、c、d四点溶液PH值大小顺序是
(4)若要把b点溶液中(CH3COO-)、(OH-)均减小,可采用的方法是 (选择正确的选项)
| A.加水 | B.加NaOH | C.加H2SO4 | D.加Na2CO3 |
(4分)已知HCO3—比HBrO更难电离,但HBrO的酸性比H2CO3弱,写出以下反应的离子方程式:
(1)向NaHCO3溶液中滴加少量溴水:
(2)向Na2CO3溶液中滴加少量溴水: