已知1.505×1023个X气体分子的质量为8g,则X气体的摩尔质量是
| A.16g | B.32g | C.32g /mol | D.64g /mol |
某同学想用实验证明高锰酸钾溶液的紫红色是MnO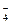 离子的颜色,而不是K+离子的颜色,他设计的下列实验步骤中没有意义的是
离子的颜色,而不是K+离子的颜色,他设计的下列实验步骤中没有意义的是
| A.将高锰酸钾晶体加热分解,所得固体质量减少 |
| B.观察氯化钾溶液没有颜色,表明溶液中K+无色 |
| C.在氯化钾溶液中加入适量锌粉振荡,静置后未见明显变化,表明锌与K+无反应 |
D.在高锰酸钾溶液中加入适量锌粉振荡,静置后见紫红色褪去,表明MnO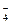 离子为紫红色 离子为紫红色 |
人体血红蛋白中含有Fe2+离子,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+离子转变成Fe3+离子,生成高铁血红蛋白而丧失与O2结合的能力。服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有
| A.酸性 | B.碱性 | C.氧化性 | D.还原性 |
混合下列各组物质使之充分反应,加热蒸干产物并在300℃灼烧至质量不变,最终残留固体为纯净物的是
| A.向CuSO4溶液中加入适量铁粉 |
| B.等物质的量浓度、等体积的(NH4)2SO4与BaCl2溶液 |
| C.等物质的量的NaHCO3与Na2O2固体 |
| D.在NaBr溶液中通入过量氯气 |
等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为5∶6,则甲、乙两烧杯中的反应情况可能分别是
| A.甲、乙中都是铝过量 | B.甲中铝过量、乙中碱过量 |
| C.甲中酸过量、乙中铝过量 | D.甲中酸过量、乙中碱过量 |
下列离子方程式正确的是()
| A.稀硫酸与氢氧化钡溶液反应 H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| B.硫酸铝溶液中滴入氨水 Al3++3OH-=Al(OH)3↓ |
| C.碳酸氢镁溶液中加入氢氧化钠溶液 Mg2++2HCO3-+4OH-=Mg(OH)2↓+CO32-+2H2O |
| D.硝酸铝溶液中滴加少量的氢氧化钠溶液 |
Al3++3OH-=Al(OH)3↓