有机物E和F可用作塑料的增塑剂或涂料的溶剂。它们的相对分子质量相等,可以用下图所示方法合成。(已知

(1)试写出有机物的名称:A____________;B____________。
(2)写出下列转化的化学方程式
A+D→E:____________ B+G→F:____________
(3)×的反应类型及其条件:类型____________;条件____________。
白磷(P4)是正四面体构型的分子,当与氧气作用形成P4O10时,每两个磷原子之间插入一个氧原子,此外,每个磷原子又以双键再结合一个氧原子。化学反应可视为旧键断裂和新键形成的过程。现提供以下化学键的键能(kJ/mol)。P-P键:198 kJ /mol ;P-O键:360 kJ /mol ;O=O键:498 kJ /mol ;P=O键:585 kJ /mol。试根据这些数据,计算出以下反应的反应热:P4(S,白磷)+ 5O2(g)= P4O10(s);
ΔH=。
已知有以下物质相互转化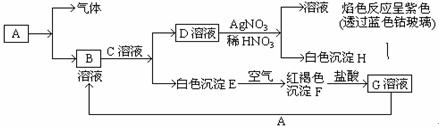
试回答:(1)写出B的化学式,D的化学式。
(2)写出由E转变成F的化学方程式。
(3)写出用KSCN鉴别G溶液的离子方程式;向G溶液加入A的有关离子反应方程式。
有A、B、C、D、E五种化合物,其中A、B、C、D是含铝元素的化合物,F是一种气体,标准状况下相对于空气的密度为1.103。它们之间有下列的转化关系:
①A+NaOH→D+H2O②B→A + H2O③C+ NaOH→B+NaCl④E+ H2O→NaOH+F
+ H2O③C+ NaOH→B+NaCl④E+ H2O→NaOH+F
⑴写出A、B、C、D的化学式:
A,B,C,E 。
。
⑵写出①③④的离子方程式:
①,
③,
④。
2004年国家食品监督局发出公告“警惕油炸食品中的丙烯酰胺(CH2=CH—CONH2)”,丙烯酰胺对人体可造成神经毒性和遗传毒性。下图流程中的有机物K是丙烯酰胺的相邻同系物。
请回答下列问题:
(1)①~⑦反应中属于加成反应的有,属于消除反应的是。
(2)写出反应条件②。
(3)写出结构简式B,H。
(4)写出下列反应的化学方程式:
C→D
E→F
水杨酸是合成阿斯匹林的重要原料。水杨酸的学名邻羟基苯甲酸,结构简式为
请回答下列问题:
(1)请写出水杨酸中除苯环外具有的官能团;
(2)请写出与水杨酸互为同分异构体,既属于酚类又属于酯类化合物的结构简式:
。
(3)写出水杨酸与碳酸氢钠反应的化学方程式:
(4)在一定条件下,水杨酸与乙酸酐可合成阿斯匹林,阿斯匹林可表示为:
则阿斯匹林的分子式为;1摩尔阿司匹林完全水解需要氢氧化钠溶液____摩尔。
(5)阿斯匹林药片需要保存在干燥处,受潮的药片易变质不宜服用;检验受潮药片是否变质的试剂是(只选一种试剂即可)