某活动课程小组拟用50mLNaOH溶液吸收CO2气体,制备Na2CO3溶液。为了防止通入的CO2气体过量生成NaHCO3,设计了如下实验步骤: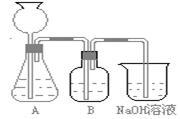
a.取25 mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
b.小火煮沸溶液1~2 min;
c.在得到的溶液中加入另一半(25mL)NaOH溶液,使其充分混合反应。
(1)此方案能制得较纯净的Na2CO3,写出a、c两步的化学反应方程____________________、____________________________。
此方案第一步的实验装置如下图所示:
(2)加入反应物前,如何检查整个装置的气密性______________________________________。
(3)装置B中盛放的试剂是______________,
作用是___________________ ____________。
(4)在实验室通常制法中,装置A还可作为下列_____________ 气体的发生装置(填序号)。
①CH2==CH2 ②H2S ③CH4 ④CH≡CH ⑤H2 (5)实验室制取下列气体:①NH3,②Cl2,③HCl,④H2S,⑤CH4,⑥CO,⑦CO2,⑧O2时,属于必须进行尾气处理,并能用下图所示装置进行处理的,将气体的序号填入装置图的下方空格内。
(5)实验室制取下列气体:①NH3,②Cl2,③HCl,④H2S,⑤CH4,⑥CO,⑦CO2,⑧O2时,属于必须进行尾气处理,并能用下图所示装置进行处理的,将气体的序号填入装置图的下方空格内。
(6)已知所用NaOH溶液中溶质的质量分数为40%,室温下该溶液密度为1.44 g / mL,假设反应前后溶液的体积不变,不考虑实验误差,计算用此种方法制备所得Na2CO3溶液的物质的量浓度为____________________。
锂亚硫酰氯(Li-SOCl2)电池具有能量密度高、工作电压和放电电压平稳、工作温度范围宽及贮存寿命长等优点,在航海、医疗及井下油田设备等方面的应用广泛。
(1)Li-SOCl2电池总反应可表示为:4Li+2SOCl2 =" 4LiCl" +S +SO2,该反应的反应物和生成物中不存在的相互作用是(填序号)。
a.离子键
b.共价键
c.氢键
d.范德华力
e.金属键
(2)亚硫酰氯(SOCl2)中硫的化合价为,1molSOCl2中的σ键数目是。S、O、Cl三种元素电负性从大到小的顺序是。
(3)在Li-SOCl2电池的碳正极中加入金属酞菁配合物可提高电池的容量和寿命。右图为一种铁酞菁配合物的结构,其中M为Fe2+,写出Fe2+的价电子排布式。请在图中用箭头表示出配位键。
(4)人们发现Li+溶剂化倾向和形成共价键倾向很强,提出类似氢键的锂键。如LiF·HF中就存在锂键,下列LiF·HF的结构式正确的是(其中锂键用…表示)。(填序号)
a. F—H…Li—F b.H—F…Li—F
周期表前四周期的元素X、Y、Z、T、W,原子序数依次增大。X的核外电子总数与其周期数相同,Y基态原子的p电子数比s电子数少1个,Z基态原子的价电子层中有2个未成对电子,T与Z同主族,W基态原子的M层全充满,N层只有一个电子。回答下列问题:
(1)Y、Z、T中第一电离能最大的是(填元素符号,下同),原子半径最小的是。
(2)T的原子结构示意图为,W基态原子的电子排布式为。
(3)X和上述其他元素中的一种形成的化合物中,分子呈三角锥形的是(填化学式);分子中既含有极性共价键,又含有非极性共价键的化合物是(填化学式,写一种)。
(4)T与Z形成的化合物中,属于非极性分子的是(填化学式)。
(5)这5种元素形成的一种阴阳离子个数比为1:1型的配合物中,阴离子呈四面体结构,阳离子的结构如图所示。该配合物的化学式为,阳离子中存在的化学键类型有。
原子形成化合物时,电子云间的相互作用对物质的结构和性质会产生影响。试回答:
(1)BF3分子的空间构型为形,[BF4]—的空间构型为形。
(2)碳原子有4个价电子,在有机化合物中价电子均参与成健,但杂化方式不一定相同。甲苯( )中碳原子的杂化方式有,甲苯能被酸性KMnO4溶液氧化成苯甲酸(
)中碳原子的杂化方式有,甲苯能被酸性KMnO4溶液氧化成苯甲酸( ),苯甲酸的沸点明显高于甲苯,其主要原因是。
),苯甲酸的沸点明显高于甲苯,其主要原因是。
(3)H+通过配位键与H2O结合形成H3O+,写出H3O+的电子式,H3O+的键角(填“大于”、“小于”或“等于”)水分子的键角。
(4)等电子原理是指原子总数相同、价电子总数相同的粒子具有相似的化学键特征。已知:CO2与N2O互为等电子体,且N2O中O原子只连1个N原子。试写出N2O的结构式。
(1)写出砷的元素符号,原子中所有电子占有______个轨道,核外共有_________个不同运动状态的电子。
(2)写出Ni的元素名称,该元素在周期表的位置为第周期,第族。
(3)第四周期基态原子中未成对电子数最多的元素是,该元素基态原子的价电子轨道表示式为。
(4)第三电子层上有________个能级,作为内层最多可容纳_______个电子,作为最外层时,最多可含有______个未成对电子。
已知溴原子的原子结构示意图如下﹕
(1)溴原子的原子的序数为_________。
(2)溴元素的原子在反应中易得到个电子,表现为 性(填氧化性或还原性)。
(3)溴元素的最高化合价 ____,最低化合价 _____。
(4)溴元素的非金属性比氯元素的非金属性 _____(填“强”或“弱”)。
(5)写出氯元素,溴元素最高价氧化物对应的水化物的化学式并比较他们的酸性强弱。