某种纯净水生产线的主要工艺流程如图: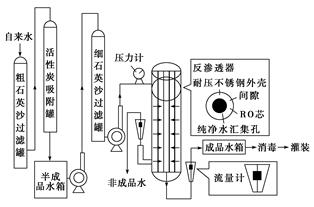
阅读该纯净水生产线的有关资料后回答问题:
资料:反渗透器的核心部件是RO芯,RO芯是由多层反渗透复合膜组成的,原用于太空宇航员进行废水再生。RO芯的孔径很小,大约是普通细菌的1/600,细小固体,有机物杂质不能透过,简单离子、水可以通过。生产时为保证成品的质量,通常控制水压使成品产率在50%左右。
RO芯部分工作参数如下:
| 硬度 |
铁 |
游离氯 |
有机物 |
… |
| <1.7 mg·L-1 |
<0.1 mg·L-1 |
0.1 mg·L-1 |
<1 mg·L-1 |
… |
(1)纯净水一定是不含任何杂质的水吗?
(2)许多食品、饮料都以大肠杆菌的含量作为卫生标准之一,主要原因是什么?
(3)水中的Ca2+和Mg2+是引起水的硬度的主要因素,硬度的表示方法是:将水中的Ca2+和Mg2+都看作Ca2+,并将其质量折算成Ca2+的质量,以1 L水中含有的CaO的质量来表示。可用一定浓度的Y溶液进行滴定,Y跟Ca2+和Mg2+都以等物质的量完全反应。该工厂现用地下水生产纯净水,取地下水样品25.0 mL,用0.0100 mol·L-1 Y溶液滴定,完全反应时消耗Y溶液15.0 mL。试判断该地下水是否可直接用来生产纯净水?
将6molA气体和2molB气体在2L密闭容器中混合并在一定条件下发生反应:3A(g)+B(g) xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L•min),请填写下列空白:
xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L•min),请填写下列空白:
①x的数值为;②A的平均反应速率为;③5min时B的转化率为。
下图是研究铜与浓硫酸的反应装置: 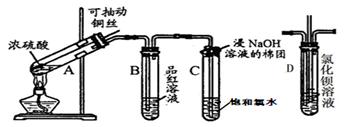
(1)A试管中发生反应的化学方程式为。
(2)反应一段时间后,可观察到B试管中的现象为。
(3)C试管口浸有NaOH溶液的棉团作用是。
(4)实验结束后,证明A试管中反应所得产物是否含有铜离子的操作方法是。
(5)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料。
| 资料1 |
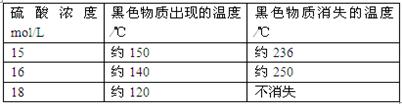 附表铜与浓硫酸反应产生黑色物质的相关性质 |
| 资料2 |
X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种。 |
仅由上述资料可得出的正确结论是。
A.铜与浓硫酸反应时所涉及的反应可能不止一个 B.硫酸浓度选择适当,可避免最后产物中出现黑色物质;C.该反应发生的条件之一是硫酸浓度≥15 mol·L D.硫酸浓度越大,黑色物质越快出现、越难消失
影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1)设计实验方案来研究影响反应速率的因素。甲同学的实验报告如下表:
| 实验步骤 |
现象 |
结论 |
| ①分别取等体积的2 mol·L-1的硫酸于试管中 |
反应速率Mg>Fe,Cu不反应 |
金属的性质越活泼,反应速率越快 |
| ②____________ |
反应物浓度越大,反应速率越快 |
(1)甲同学表中实验步骤②为_________________________________________。
(2)甲同学的实验目的是_____________;要得出正确的实验结论,还需控制的实验条件是____________。乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验。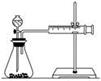
(3)乙同学在实验中应该测定的数据是___________________________________________________。
(4)乙同学完成该实验应选用的实验药品是________,该实验中不选用某浓度的硫酸,理由是___________。
实验二:已知 2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(5)针对上述实验现象,丙同学认为KMnO4与H2C2O4反应放热,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是______________的影响。
(6)若用实验证明你的猜想,除高锰酸钾酸性溶液、草酸溶液外,还需要选择的试剂最合理的是________(填字母)。
A.硫酸钾 B.硫酸锰 C.二氯化锰D.水
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,Q、W、Z是非金属元素。五种元素核电荷数之和为55,对应原子最外层电子数之和为21。W、Z最外层电子数相同,但Z的核电荷数是W的2倍。
(1)Q在周期表中位于第周期族。
(2)X、Y各自的最高价氧化物对应的水化物可以发生反应生成盐和水,请写出该反应的离子方程式:。
(3)X单质能在W单质中燃烧可生成化合物R,R的电子式___,该物质所含有的化学键的类型为。
(4)Z的氢化物与W的氢化物发生反应生成Z单质和水,写出其化学方程式。
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.下图为氢氧燃料电池的结构示意图,
电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
(1) 写出氢氧燃料电池工作时正极电极反应方程式: ___________。
(2)如果该氢氧燃料电池每转移0.1mol电子,消耗标准状况下___________L氧气。
(3) 若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极反应式为___________________。电池总离子反应方程式为_______________________________。