有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4mol/L,SO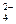 的物质的量浓度为0.7 mol/L,则此溶液中K+的物质的量浓度为( )
的物质的量浓度为0.7 mol/L,则此溶液中K+的物质的量浓度为( )
| A.0.1 mol/L | B.0.15 mol/L | C.0.2 mol/L | D.0.25 mol/L |
一定条件下,体积为10L的密闭容器中,1molX和1molY进行反应:
2X(g)+Y(g) Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是:()
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是:()
A.将容器体积变为20L,Z的平衡浓度变为原来的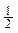 |
| B.以X浓度变化表示的反应速率为0.001mol/(L·S) |
| C.若增大压强,则物质Y的转化率减小 |
| D.若升高温度,X的体积分数增大,则该反应的△H>0 |
下列有关金属腐蚀与防护的说法正确的是:()
| A.纯银器表面在空气中因化学腐蚀渐渐变暗 |
| B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
| C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阴极的阳极保护法 |
| D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
已知:Ksp(AgCl)=1.8×10—10,Ksp(AgI)=1.5×10—16 ,Ksp(Ag2CrO4)=2.0×10—12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是:()
| A.AgCl>AgI> Ag2CrO4 | B.AgCl> Ag2CrO4>AgI |
| C.Ag2CrO4>AgI>AgCl | D.Ag2CrO4>AgCl>AgI |
短周期元素A、B、C、D的原子序数依次递增,它们的原子序数之和为32,原子最外层电子数之和为10。A与C同主族,B与D同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数。则下列叙述正确的是()
A.一定条件下,B单质能置换出D单质,C单质能置换出A单质
B.D元素处于元素周期表中第3周期第IV族
C.B的最高价氧化物中,B与氧原子之间为非极性共价键
D.四种元素的原子半径:A>B>D>C
低合金高强度钢Q460是支撑“鸟巢”的铁骨钢筋,除含有铁元素外,还含有Mn(锰)、Ti(钛)、Cr(铬)、Nb(铌)等合金元素,下列有关说法正确的是()
| A.Fe位于元素周期表的第四周期、第ⅧB族 |
| B.工业上利用热还原法冶炼金属Fe、Cr、Mn |
C.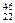 TiO2、 TiO2、 TiO2、 TiO2、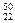 TiO2互为同位素 TiO2互为同位素 |
D. Nb3+原子核内有51个中子,核外有41个电子 Nb3+原子核内有51个中子,核外有41个电子 |