实验室为了制得少量漂白粉,常用浓盐酸与二氧化锰先制取氯气,再用氯气与消石灰反应。已知氯气与氢氧化钙制漂白粉是放热反应[2Cl2+2Ca(OH)2 Ca(ClO)2+CaCl2+2H2O(反应放热)],温度稍高即会发生副反应6Cl2+6Ca(OH)2
Ca(ClO)2+CaCl2+2H2O(反应放热)],温度稍高即会发生副反应6Cl2+6Ca(OH)2 Ca(ClO3)2+5CaCl2+6H2O。现有甲、乙、丙三套装置(U形管中放有玻璃纤维,可使气体顺利通过)。
Ca(ClO3)2+5CaCl2+6H2O。现有甲、乙、丙三套装置(U形管中放有玻璃纤维,可使气体顺利通过)。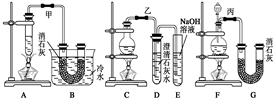
(1)请对三套装置的优缺点进行评价,并将选项序号填于下表内。a.容易引起环境污染
b.可防止环境污染 c.可防止副反应发生 d.易发生副反应 e.易控制反应速率 f.不易控制反应速率
| |
优点 |
缺点 |
| 甲装置 |
|
|
| 乙装置 |
|
|
| 丙装置 |
|
|
(2)请从甲、乙、丙三套装置中,选取合理的组成部分(A、B、C、D、E、F、G)组装一套你认为更完整的实验装置,则连接顺序为(按气流从左到右方向) 。
(3)在你所设计的装置及以上甲、乙、丙装置中,是否还缺少其他必要的装置,说明原因: 。
有硫酸钾和碳酸镁的混合物,用50 mL盐酸完全溶解后,在标准状况下收集到0.56L二氧化碳,向反应后的溶液中加入含有0.03 mol氢氧化钡的溶液,可得到6.11g沉淀,此时溶液的pH=12,溶液的体积为200mL,试求:
(1)原混合物中碳酸镁的物质的量为__________________mol。
(2)得到的沉淀中硫酸钡的质量为______________g。
(3)盐酸的物质的量浓度为_________________mol/L。
(8分)硫酸亚铁晶体( )在医药上作补血剂。
)在医药上作补血剂。 某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
(1) 步骤②加入过量H2O2的目的:____________________
(2) 若实验无损耗,则每片补血剂含铁元素的质量__________g(用含a的代数式表示)。
(3) 该小组有些同学认为用酸性.KMnO4溶液滴定也能进行铁元素含量的测定。
①写出酸性KMnO4溶液和FeSO4反应的离子方程式______________ ________________
________________
②实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除托盘天平、玻璃棒、烧杯、胶头滴管外,还需____________________
③上述实验中的KMnO4,溶液需要酸化,用于酸化的酸是______ ____。
____。
a.稀硝酸b.稀硫酸c.稀盐酸d.浓硝酸
④某同学设计的下列滴定方式中,最合理的是__________ (夹持部分略去)(填字母序号)。
(12分)某实验小组利用如下图所示装置完成有关实验。
(1) 有关 气体的制取、收集、尾气处理问题
气体的制取、收集、尾气处理问题
①仪器a的名称:__________,若装置I用于制取SO2,则反应的化学方程式为: __________
装置III可用于气体的吸收,若用于吸收Cl2,则IH中所盛放液体为____________________
| A.水 | B.浓硫酸 | C.NaOH溶液 | D.饱和NaCl溶液 |
②装置II可以是收集装置也可以是洗气装置.若用来收集N0,请简述其操作方法:____________________
(2) 比较碳、硅两种元素的非金属性强弱(a中装的盐酸、装置II中装有Na2SiO3溶液)
则装置II中盛放的溶液为____________________
装置III中反应的离子方程式为____________________
如图所示,是一个制取氯气并以氯气为原料进行特定反应的装置,其中各试剂瓶装的试剂为: B(适量澄清石灰水溶液),C(水),E(紫色石蕊试液)。
(1)A是氯气发生装置 ,蒸
,蒸 馏烧瓶中盛放MnO2固体,其化学反应方程式是:。
馏烧瓶中盛放MnO2固体,其化学反应方程式是:。
(2)实验开始时,先点燃A处酒精灯,打开分液漏斗旋塞和Ⅰ处活塞,让氯气充满整个装置,再点燃D处酒精灯,请写出B中的化学方程式
(3)在D装置的硬质玻璃管内盛有碳粉,发生氧化还原反应,一种产物能使E处紫色石蕊试液变红,另一产物能使澄清石灰水变浑浊,写出D中的反应的化学方程式_________。
(4)在E处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是。
(5)D处反应完毕后关闭分液漏斗旋塞,移去酒精灯,但由于余热的作用,A处仍有氯气产生,此时应该怎样操作 ;装置Ⅰ中的现象是。
;装置Ⅰ中的现象是。
(6)若将C中的水换成氢氧化钠溶液,溶液中不但有NaClO还有NaClO3,其物质的量比为2:1,则氧化剂和还原剂的物质的量比为:。
阅读、分析下列两个材料:
材料一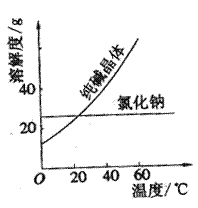
材料二
| 物质 |
熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
溶解性 |
| 乙二醇 C2H6O2 |
-11.5 |
198 |
1.11 |
易溶于水和乙醇 |
| 丙三醇C3H8O3 |
17.9 |
290 |
1.26 |
能跟水、酒精以任意比互溶 |
根据上述材料及课本知识,回答下列问题(填写序号):
A.蒸馏法 B.萃取法 C.“溶解、结晶、过滤”的方法 D.分液法E.层析
⑴将纯碱从氯化钠和纯碱的混合物中分离出来,最好应用______________,
⑵将乙二醇和丙三醇相互分离的最佳方法是______________,
⑶用CCl4提取溴水中的溴单质的最佳方法是_____________,
⑷分离汽油和水的最佳方法是_______________。