如图是甲同学设计的证明CO具有还原性的实验装置。回答下列问题: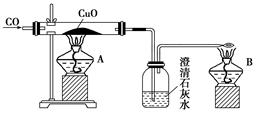
(1)实验时应先点燃________(填“A”或“B”)处的酒精灯。
(2)洗气瓶中的现象为__________________________________________________________。
(3)酒精灯B的作用是_________________________________________________________。
(4)乙同学提出甲设计太复杂,可将酒精灯合二为一,去掉B而将尾气导管口旋转到A的火焰上即可,乙同学设计是否合理?________;理由是______________________________。
(5)丙同学质疑CO能否使石灰水变浑浊,因此其设计在CO通入CuO之前应先通过澄清石灰水以排除CO与澄清石灰水反应,试对此做出评价,你认为丙的设计________(填“必要”或“不必要”),理由是____________________________________________。
(6)丁同学认为甲设计的装置中尾气处理还可以用其他方法,请你为丁同学设计一种合理的尾气处理方法:________________________________________。
为确定某卤代烃分子中所含卤原子的种类,可按下列步骤进行实验:
a.取少量该卤代烃液体;
b.加入适量NaOH溶液,加热;
c.冷却后加入稀硝酸酸化;
d.加入AgNO3溶液,观察反应现象。
回答下列问题:
(1)①步骤b的目的是_______________________________________________;
②步骤c的目的是_______________________________________________。
(2)若加入AgNO3溶液时产生的沉淀为浅黄色,则此卤代烃中的卤素原子是____(填元素符号)。
(3)能否向该卤代烃中直接加AgNO3溶液确定卤素原子的种类?为什么?
在复习元素周期律过程中,某研究性学习小组的几位同学拟通过具体的实验来探讨某些金属元素的性质差异,下面是他们设计的探究性实验方案,请填写下列空白:
(1)实验目的:比较钠、镁、铝金属性强弱。
(2)实验用品:酒精灯、 、试管、试管夹、砂纸、滤纸;钠、镁条、铝片、酚酞、蒸馏水、6 mol·L-1的盐酸
(3)实验过程与现象记录
Ⅰ.甲同学的方案如下:
| 实验过程 |
预期现象 |
实际观察到的现象 |
| a取已切去表皮的一小块金属钠,放入盛有水的某容器中 |
立即剧烈反应 |
开始时钠块浮在水面上不反应,稍后才开始与水剧烈反应 |
| b向盛有适量水(内含2滴 酚酞的试管中加入一小段镁条 |
有气泡产生,溶液变红色 |
没有相应现象,加热后仍无明显变化 |
| c向两支盛有3mL6mol·L-1盐酸的试管中加入大小相同的镁片和铝片 |
镁、铝与盐酸反应产生气泡剧烈程度不同 |
镁与盐酸反应产生气泡速率较快 |
①你认为a、b两步实验中出现异常现象的可能原因是:
a
b
②上面的实验表明:钠、镁、铝三种元素的金属性由强到弱的顺序为
Ⅱ乙同学的方案:他认为只需要一种试剂就可以确定钠、镁、铝的金属性强弱,预计他的主要实验操作
是
(每空1分,共8分)利用生活中或实验室中常用的物品,根据氧化还原反应知识和电学知识,自己动手设计一个原电池。请填写下列空白:
(1)实验原理:Fe+2H+=Fe2++H2↑。
(2)实验用品:电极( 、 )、稀硫酸、 (填写所缺的实验用品)、耳机(或者电流计)。
(3)实验装置:
(4)原电池设计及注意的问题。
①按如图所示连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一个极是连接在原电池的另一个电极上的),这时可以听见耳机发出“嚓嚓嚓”声音。其原因是:在原电池中,由化学能转化为 。
②如果将装置中的耳机改为电流计,则铁钉应该接电流计的 极,电极反应是 ;另一极应该接电流计的 极,电极发生了 反应(“氧化”或“还原”)。
下图为实验室干馏煤的装置图。请回答下列问题:
(1)指出图中个仪器的名称:a. ;b. ;c. ;d. 。
(2)装置c的作用是 ,d中的液体有 和 。其中无机物里溶有 ,
可用 检测出来,有机化合物可以通过 的方法使其中的重要成分分离出来。在170-230 ℃时可以得到 ,加热到230 ℃,可以得到 。
(3)e处点燃的气体主要是 ,火焰的颜色是 色。
海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
已知:①海水中溴元素(以Br-表示)的浓度0.068g/L;
②Br2的沸点为59 ℃,微溶于水,有毒性和强腐蚀性。
(1)请写出一种海水淡化的方法:_____________。
(2)海水中溴离子的物质的量浓度为_____________ 。
(3)步骤Ⅰ中已获得低溶度的含Br2溶液,步骤Ⅱ中又将Br2还原为Br-,步骤Ⅲ又得到Br2,其目的为________________。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为 。
(5)工业溴提纯可用蒸馏法,蒸馏时加热方法最好采用 ,蒸馏装置中仪器连接均不能用橡胶塞和橡胶管,其原因是_________________________________。