设NA表示阿伏加得德罗常数的数值,下列叙述中正确的是
| A.1 mol NH3所含有的氢原子数为3NA |
| B.常温常压下,22 .4 L氧气所含的原子数为2NA |
| C.常温常压下,48 g O3所含的氧原子数为3NA |
| D.1 L 0.1 mol/LNaCl溶液中所含的Na+为NA |
如图所示,隔板K1固定不动,活塞K2可 自由移动。T℃时,M、
自由移动。T℃时,M、 N两个容器中均发生反应N2(g)+3H2(g)
N两个容器中均发生反应N2(g)+3H2(g)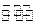 2NH3(g),向容器M、N中各充入l mol N2和3 mol H2,初始M、N的容积和温度相同,并保持温度不变。下列有关说法中不正确的是()
2NH3(g),向容器M、N中各充入l mol N2和3 mol H2,初始M、N的容积和温度相同,并保持温度不变。下列有关说法中不正确的是()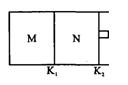
A.反应达到平衡时N2的转化率:M>N |
| B.H2的体积分数:M>N |
C.容器N中达到平衡,测得容器中含有1.2mol NH3,此时N的容积为VL,则该反应在此条件下的平衡常数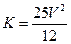 |
| D.该反应在T℃时的平衡常数K:M=N |
已知在常温下测得浓度均为0.1 mol·L-1的下列三种溶液的pH:
| 溶质 |
NaHCO3 |
Na2CO3 |
NaCN |
| pH |
8.4 |
11.6 |
11.1 |
下列说法中正确的是()
| A.阳离子的物质的量浓度之和:Na2CO3>NaCN>NaHCO3 |
| B.相同条件下的酸性:H2CO3<HCN |
| C.三种溶液中均存在电离平衡和水解平衡 |
D.升高Na2CO3溶液的温度,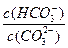 减小 减小 |
目前市场上主流手机所配的电池基本上都是锂离子电池。它的负极材料是金属锂和碳的复合材料,组成为C6Li,其中碳作为金属锂的载体,电解质为一种能传导Li+的有机导体或高分子材料。这种锂离子电池的电池反应式为:0.45Li+Li0.56CoO2 LiCoO2下列说法不正确的是()
LiCoO2下列说法不正确的是()
| A.放电时电池内部Li+向负极移动 |
| B.该电池不能选用水做溶剂的电解质 |
| C.放电时,正极的电极反应式:0.45Li++Li0。55CoO2+0.45e- |
| D.充电时,外接电源的正极与电池上标注“+”的电极连接 |
下列离子或分子组中能大量共存,且满足相应要求的是()
| 选项 |
离子 |
要求 |
| A |
K+、NO3-、Cl-、HS- |
c(K+)<c(Cl-) |
| B |
Fe3+、NO3-、SO32-、Cl- |
逐滴滴加盐酸立即有气体产生 |
| C |
Na+、HCO3-、Mg2+、SO42- |
逐滴滴加氨水立即有沉淀产生 |
| D |
NH4+、Al3+、SO42-、CH3COOH |
滴加NaOH浓溶液立刻有气体产生 |
用NA表示阿伏加德罗常数的值,则下列叙述正确的是()
| A.常温下,4.48 L N2和O2的混合气体中所含原子数为0.4NA |
| B.常温下,1.0L 1.0 mol·L-1NaAlO2溶液中含有的氧原子数为2NA |
| C.7.8 g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA |
| D.0.1 mol Fe参加氧化还原反应,转移的电子数目一定是0.2 NA |