合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为:N2(g)+3H2(g)  2NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。
2NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。
回答下列问题:
(1)合成氨工业中原料气压缩到30~50MPa的原因是 。从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400~500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是 。
(2)500℃、50MPa时,在容积为VL的容器中加入n mol N2、3n mol H2,反应达平衡后测得平衡常数为K,此时N2的转化率为x。则K和x的关系满足K= 。
(3)甲烷在高温下与水蒸气反应反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g)。部
分物质的燃烧热数据如下表:
| 物 质 |
燃烧热(kJ·mol-1) |
| H2(g) |
-285.8 |
| CO(g) |
-283.0 |
| CH4(g) |
-890.3 |
已知1mol H2O(g)转变为1mol H2O(l)时放出44.0 kJ热量。写出CH4和H2O(g)在高温下反应的热化学方程式 。
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池。请写出该电池的正极反应式 。
(10分)A、B、C、D分别是NaNO3、NaOH、HNO3和Ba(NO3)2四种溶液中的一种,现利用另一种溶液X,用如图所示的方法可将它们依次确定。试确定A、B、C、D、X各代表何种溶液。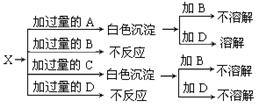
A:________,B:________,C:_______,D:_______,X:_______。
(4分)某氯化钾样品中含杂质硫酸钾,为了除去硫酸钾,要做以下6步实验:
A向滤液中滴加稀盐酸,边滴边振荡至不再产生气体
B将氯化钾样品溶于适量蒸馏水,配成溶液
C过滤,将白色沉淀滤出
D向溶液中滴加碳酸钾溶液边滴,边振荡至不再产生白色沉淀
E向溶液中滴加氯化钡溶液,边振荡至不再产生沉淀
F将滤液蒸干,得到晶体
(1)正确的实验操作程序为(填写序号)____________________
(2)进行F操作时用到的仪器主要有____________
(8分)
(1)写出下列反应的离子方程式
①Ca(HCO3)2与过量的NaOH溶液的反应:
②CH3COOH溶液与NaOH溶液反应:
(2)写出下列反应的离子方程式,并在离子方程式中用“单线桥”表示电子转移的方向和数目:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
如果此反应生成了5molCl2,发生氧化反应的HCl的物质的量为mol。
已知: 2Fe2+ + Br2=2Fe3++2Br-;Cl2+2Br-= Br2+2Cl-
在含n mol FeBr2的溶液中,通入Cl2,有x mol Cl2发生反应。
(1)当 时,反应的离子方程式为_________________________
时,反应的离子方程式为_________________________
(2)当反应的离子方程式为:3Cl2+2Fe2+ +4Br-=2Br2+2Fe3+ +6Cl-时,x与n的关系为_____
(3)当Fe2+和Br-同时被氧化时,x与n的关系是_______________
(4)当x=n时,反应后氧化产物的物质的量为________________
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Ca2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生;
第二份加入足量NaOH溶液加热后,收集到0.08mol气体;
第三份加入足量BaCl2溶液后,得到干燥沉淀12.54g,经足量的盐酸洗涤、干燥后,沉淀质量为4.66g。
根据上述实验,回答以下问题:
(1)由第一份进行的实验推断该混合物是否一定含有Cl- ,
(2)由第二份进行的实验可知混合物中应含离子,其物质的量浓度为。
(3)由第三份进行的实验可知12.54g 沉淀的成份为。请计算形成该沉淀的原混合物中各离子的物质的量。
(4)综合上述实验,你认为以下结论正确的是()
| A.该混合物中一定含有K+、NH4+、CO32-、SO42-,可能含有Cl-,且n(K+)≥0.04mol |
| B.该混合物中一定含有NH4+、CO32-、SO42-,可能含有Ca2+、 K+、Cl- |
| C.该混合物中一定含有NH4+、CO32-、SO42-,可能含有K+、Cl- |
| D.该混合物中一定含有NH4+、SO42-,可能含有Ca2+、K+、Cl- |