⑴、等质量的下列烃,燃烧时产生CO2最多的是________,产生H2O最多的是________,消耗O2最多的是________。
⑵、120℃时燃烧下列气态烃,燃烧后气体体积增大的是________,体积减小的是________,不变的是________。
| A.CH4 | B.C2H4 | C.C2H6 | D.C3H8 E、C2H2 |
①将一小块金属钠长期露置于空气中发生一系列变化,最终产物是;②用脱脂棉包住约0.2g过氧化钠粉未,置于石棉网上,往脱脂棉上滴几滴水,可观察到脱脂棉燃烧起来。由实验现象所得出的有关过氧化钠和水反应的结论是:
a:有氧气生成;b。
Na2O2和水反应的化学方程式是。
0.1molAl2(SO4)3中含Al3+个, SO42-mol;同温同压下,等体积的CO和CO2所含分子数之比为。
(10分)合成氨反应原理为:N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ·mol-1一种工业合成氨的简易流程图如下:
2NH3(g) ΔH=-92.4 kJ·mol-1一种工业合成氨的简易流程图如下: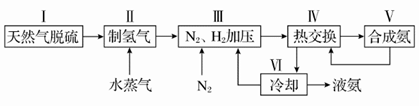
(1)步骤Ⅱ中制氢气原理如下:
①CH4(g)+H2O(g)  CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是 ________。
a.升高温度b.增大水蒸气浓度c.加入催化剂d.缩小容器的体积
利用反应②,将CO进一步转化,可提高H2产量。若2 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到2.2 mol CO、CO2和H2的混合气体,则CO转化率为________。
(2)图中表示500℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算H2的平衡体积分数:________。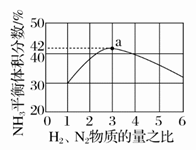
(3)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)________。简述两点本流程中提高合成氨原料总转化率的方法:_______________________________________。
已知Fe(s)+CO2(g) FeO(s)+CO(g) K1…①
FeO(s)+CO(g) K1…①
Fe(s)+H2O(g) FeO(s)+H2(g) K2…②
FeO(s)+H2(g) K2…②
H2(g)+CO2(g) H2O(g)+CO(g) K3…③
H2O(g)+CO(g) K3…③
又已知不同温度下,K1、K2值如下:
| 温度℃ |
K1 |
K2 |
| 500 |
1.00 |
3.15 |
| 700 |
1.47 |
2.26 |
| 900 |
2.50 |
2.00 |
| 温度℃ |
K1 |
K2 |
| 500 |
1.00 |
3.15 |
| 700 |
1.47 |
2.26 |
| 900 |
2.50 |
2.00 |
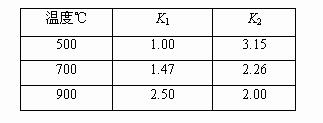
(1)若500℃时进行反应①,CO2起始浓度为1.6 mol·L-1, 4分钟后建立平衡,用CO表示的反应速率为。
(2)900℃ 进行反应③,其平衡常数K3为(求具体数值),焓变ΔH0(填“>”、“=”或“<”),若已知该反应仅在高温时正反应自发,则ΔS0(填“>”、“=”或“<”)。
(3)下列图像符合反应②的是(填序号)(图中v是速率,φ为混合物中H2的体积百分含量)。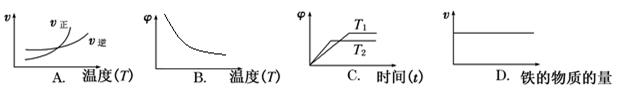
(12分)某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中的溶质足量),当闭合该装置的电键K时,观察到电流表的指针发生了偏转。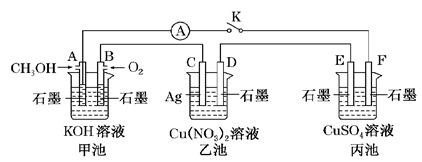
请回答下列问题:
(1)甲池为________(填“原电池”、“电解池”或“电镀池”),A电极的电极反应式为_____________。
(2)丙池中F电极为________(填“正极”、“负极”、“阴极”或“阳极”),该池的总反应方程式为____________________________________________________________。
(3)当乙池中C极质量减轻10.8 g时,甲池中B电极理论上消耗O2的体积为________mL(标准状况)。
(4)一段时间后,断开电键K。下列物质能使乙池恢复到反应前浓度的是________(填字母)。
| A.Cu | B.CuO | C.Cu(OH)2 | D.Cu2(OH)2CO3 |