①NaOH溶液 ②铜丝 ③液态HCl ④盐酸 ⑤稀硫酸 ⑥液氨 ⑦氨水 ⑧SO2 ⑨胆矾晶体 ⑩熔融NaCl ⑾蔗糖晶体 ⑿酒精 ⒀酒精溶液
(1)上述状态下可导电的是_________________;
(2)于非电解质的是______________________;
(3)述状态下的电解质不能导电的是____________________。
有A、B、C三瓶失去标签的无色溶液:K2CO3、BaCl2、Na2SO4。首先不用其他试剂就可鉴别出的是,如要继续鉴别余下两种,还需要选用的试剂是,现象分别为。
对于混合物的分离或提纯,常采用的方法有:①过滤、②蒸发、③蒸馏、④萃取、⑤加热分解等。下列各组混和物的分离或提纯应采用什么方法?(填序号)
(1)提取碘水中的碘 ___________(2)除去食盐溶液中的水 ___________
(3)淡化海水 (5)KCl中含有KClO3
以乙烯为原料合成化合物C的流程如下所示:
(1) 乙醇和乙酸中所含官能团的名称分别为:和。
(2) B物质的结构简式为 。
(3) ① 、④的反应类型分别为反应和反应。
(4) 反应②和④的化学方程式分别为:
②;②。
接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
2SO2(g)+O2(g)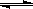 2SO3(g)△H=-190 kJ·mo1-1
2SO3(g)△H=-190 kJ·mo1-1
(1)在一个固定容积为5L的密闭容器中充入0.20 mol SO2和0.10molO2,半分钟后达到平衡,测得容器中含SO3 0.18mol,则v(O2)=mol·L-1·min-1
(2)下列条件的改变能加快其反应速率的是(选填序号)
①升高温度②保持体积不变,只增加氧气的质量
③保持体积不变,充入Ne使体系压强增大④保持压强不变,充入Ne使容器的体积增大
(3)下列描述中能说明上述(1)反应已达平衡的是(选填序号)
①v(O2)正=2v(SO3)逆②SO2、O2、SO3的浓度之比为2:1:2
③单位时间内生成2n molSO2的同时生成2n mol SO3④容器中气体的平均分子量不随时间而变化
⑤容器中气体的密度不随时间而变化⑥容器中气体压强不随时间而变化
(4)在相同条件下发生上述反应,若要得到380kJ热量,则加入各物质的物质的量可能是。
| A.4 mo1SO2和2mol O2 | B.6mol SO2和6mo1 O2 |
| C.4mol SO2和4 mo1 O2 | D.6mo1 SO2和4 mo1 O2 |
(9分)水是组成生命体的重要化学物质,有关水的反应有很多。
(1)用电子式表示H2O的形成过程 。
(2)在pH=1的水溶液中,①NH4+、Al3+、Br-、SO42-② Na+、Fe2+、Cl-、NO3-
③K+、Ba2+、Cl-、NO3-④K+、Na+、HCO3-、SO42-四组离子中,一定大量共存的是(填序号)。
(3)在下列反应中,水仅做氧化剂的是,水既不做氧化剂又不做还原剂的是。
| A.2F2+2H2O=4HF+O2 | B.2Na2O2+2H2O=4NaOH+O2↑ |
| C.CaH2+2H2O=Ca(OH)2+2H2↑ | D.3Fe+4H2O Fe3O4+4H2 Fe3O4+4H2 |
(4)“神舟七号”飞船上的能量主要来自于太阳能和燃料电池,H2、O2和KOH的水溶液可形成氢氧燃料电池,负极的电极反应为,反应产生的水经冷凝后可作为航天员的饮用水,当得到1.8 L饮用水时,电池内转移的电子数为。