下列各组物质间反应可能包括多步反应,其总的离子方程式正确的是 ( )
| A.等体积、等物质的量浓度的明矾溶液和Ba(OH)2溶液混合: 3Ba2++6OH -+2Al3++3SO42- ="==" 2Al(OH)3↓+3BaSO4↓ |
| B.FeCl2在空气中被氧化:4Fe2+ + O2 + 2H2O = 4Fe3+ + 4OH - |
| C.AlCl3 (aq)中投入过量Na:2Al 3+ + 6Na + 6H2O = 2Al(OH)3 ↓ + 6Na+ + 3H2↑ |
| D.FeBr2 (aq) 中通入少量Cl2:2Fe2+ + 4Br- + 3Cl2 = 2Fe3+ + 2 Br2 + 6Cl- |
一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料电池说法正确的是()
| A.在熔融电解质中,O2-由负极移向正极 |
| B.通入空气的一极是正极,电极反应为:O2+2H2O+4e-=4OH- |
| C.通入丁烷的一极是负极,电极反应为:C4H10+26e-+13O2-=4CO2+5H2O |
D.在电池反应中,每消耗1 mol氧气,理论上能生成标准状况下CO2气体为 L L |
氢氧燃料电池可同时供应电和水蒸气,所用燃料为H2,电解质为熔融的K2CO3。已知该电池的正极反应为:O2+2CO2+4e-=2C 。下列叙述正确的是()
。下列叙述正确的是()
A.放电时C 向正极移动 向正极移动 |
| B.放电时OH-向负极移动 |
C.负极反应为H2+C -2e-=H2O+CO2 -2e-=H2O+CO2 |
| D.当该电池产生的水蒸气折算成标准状况下的体积为22.4 L时,转移电子4 mol |
某钠盐溶液中可能含有NO2-、SO42-、SO32-、CO32-、Cl-、NO3-等阴离子。某同学取5份此溶液样品,分别进行了如下实验:
①用pH计测得溶液pH大于7
②加入盐酸,产生有色刺激性气体
③加入硝酸酸化的AgNO3溶液产生白色沉淀,且放出有色刺激性气体
④加足量BaCl2溶液,产生白色沉淀,该沉淀完全溶于稀硝酸且放出气体,将气体通入品红溶液,溶液不褪色
⑤加足量BaCl2溶液,产生白色沉淀,在滤液中加入酸化的(NH4)2Fe(SO4)2溶液,再滴加KSCN溶液,显红色
则下列说法不正确的是
| A.由②中的实验现象可推测一定含有NO2- |
| B.根据②③④可确定一定含有NO2-、CO32-、Cl-三种阴离子 |
| C.不能确定是否一定含有NO3- |
| D.由④即可确定一定不存在SO42-、SO32- |
下列关于甲、乙、丙、丁四个图像的说法中,正确的是
| A.甲是亚硫酸氢钠粉末投入稀硝酸溶液中有关图像 |
| B.乙是等pH值的MCl2和NCl2溶液稀释时pH值变化图,由此可推测M的金属性较强 |
| C.由丙可知,双氧水在有催化剂存在时的热化学方程式为2H2O2(l)=2H 2O(l)+O2(g)△H=—2(Ea2′-Ea2) kJ·mol-1 |
| D.丁是向硝酸银溶液中滴加氨水时,沉淀质量与氨的物质的量的关系图 |
在能源和环保的压力下,新能源电动汽车无疑将成为未来汽车的发展方向。如果电动汽车上使用新型钒电池,一次性充电3—5分钟后,续航能力可达1000公里;而成本造价只有目前锂电池的40%,体积和重量分别是锂电池的1/25和1/10。全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示: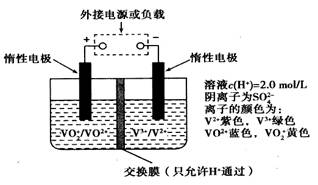
下列有关该钒电池的说法不正确的是:
| A.该电池为可逆电池, 当左槽溶液逐渐由黄变蓝时,为充电过程,此时左槽溶液pH值升高 |
| B.放电过程中,右槽溶液中溶液颜色由紫色变为绿色 |
| C.充电过程中, H+可以通过质子交换膜向右移动,形成电流通路,并且参与电极反应 |
D.充电时若转移的电子数为3.01 1023个,左槽溶液中n(H+)增加了0.5mol 1023个,左槽溶液中n(H+)增加了0.5mol |