某溶液 仅含下表离子中的5种(不考虑水的电离及离子的水解)且各种离子物质的量均为1mol。
仅含下表离子中的5种(不考虑水的电离及离子的水解)且各种离子物质的量均为1mol。
| 阳离子 |
Na+ Mg2+ Fe3+ Al3+ Fe2+ |
| 阴离子 |
OH- CO32- Cl- NO3- SO42- |
①若向溶液中加入KSCN溶液无明显变化;
②若向原溶液中加入稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,且溶液中阴离子种类不变;
请推断:
(1)原溶液中含有阳离子: ;含有阴离子: ;
(2)向原溶液中加入足量稀盐酸发生反应的离子方程式: ;
(3)若向原溶液中加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为 g。
A是一种重要的化工原料,它的产量可以衡量一个国家石油化工水平的高低。A、B、C、D在一定条件下存在如下转化关系(部分反应条件、产物被省略)。
(1)工业上,由石油获得石蜡油的方法是_________,由石蜡油获得A是________变化。
(2)写出A→B的反应方程式:
该反应的类型是____________________
写出反应B+C→D的化学方程式:____________________________
该反应的类型是。
(3)使1molA与氯气发生完全加成反应,然后使该加成反应的产物与氯气在光照的条件下发生完全取代反应,则两个过程中消耗的氯气的总的物质的量是mol
(4)实验室制备D的实验装置图如图所示:收集产物的试管中盛放的液体为;该溶液的作用有:
①除掉产物中的和杂质;
②
(5)在制备乙酸乙酯过程中,往往加入的乙酸和乙醇的量要比理论计算量多得多,请解析其中可能存在的原因:
①
②
下图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
(1)当电极a为Al、电极b为Cu、电解质溶液为稀硫酸时,写出该原电池的总的离子反应反应方程式:
正极的电极反应式为:
当a极溶解的质量为5.4g时,有mol电子通过导线
(2)当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,
该装置(填“能”或“不能”)形成原电池,
若不能,请说明理由(若能该空不作答),
若能,该原电池的正极为;该原电池总的化学反应方程式为:
( 4分)烷基取代苯 R可以被KMnO4的酸性溶液氧化生成
R可以被KMnO4的酸性溶液氧化生成 COOH,但若烷基R中直接与苯环连接的碳原子上没有C一H键,则不容易被氧化得到
COOH,但若烷基R中直接与苯环连接的碳原子上没有C一H键,则不容易被氧化得到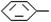 COOH。现有分子式是C11H16的一烷基取代苯,已知它可以被氧化成为
COOH。现有分子式是C11H16的一烷基取代苯,已知它可以被氧化成为 COOH的异构体共有7种,其中的3种是
COOH的异构体共有7种,其中的3种是 CH2CH2CH2CH2CH3,
CH2CH2CH2CH2CH3,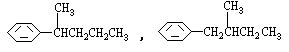
请写出其他4种的结构简式:
_________________、________________、_________________、___________________。
元素在周期表中的位置,反映了元素的原子结构和元素的性质。下图是元素周期表的一部分。请用元素符号或化学式填空: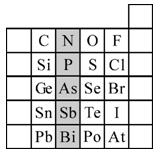
(1)所示元素中
①非金属性最强的元素是:
②金属性最强的元素是:
③原子半径最小的是:
④最高价含氧酸酸性最强的是
⑤经常用作半导体材料的元素是:(只写一种)
⑥阴影部分属于元素周期表中的族,该族元素的最高正价均为
(2)根据元素周期律,推导:
①酸性强弱: H3AsO4 H3PO4(用“>”或“<”表示,下同);
②稳定性:H2SHCl
③沸点:HFHCl
④还原性:I-Br-
⑤在O、F、S、Cl四种元素中,非金属性最接近的是:
A.O和F B.F和S C.S和Cl D.O和Cl
(3)根据同主族元素性质的相似性和递变性进行预测:
①关于Se的预测正确的是:
A.常温下Se单质是气体
B.Se最高价氧化物的水化物能和NaOH发生反应
C.氢化物的化学式为H2Se
D.常见的氧化物只有SeO3
②已知Cl2在水溶液中能和SO2反应,Cl2+2H2O+SO2==H2SO4+2HCl,写出Br2在水溶液中和SO2反应的离子反应方程式___________________________________
A是在人们日常生活中最常见的有机物,75℅(体积分数)的水溶液可用于医疗消毒,并能进行如图所示的多种反应,通常情况下C是一种具有果香味的无色液体。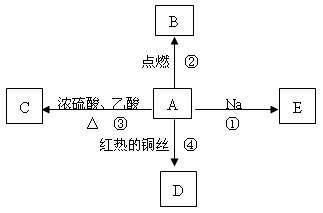

 (1)A的名称;C的分子式为。
(1)A的名称;C的分子式为。 (2)写出下列反应的化学方程式:
(2)写出下列反应的化学方程式: 反应②;
反应②; 反应④。
反应④。 (3)比较反应①与钠和水反应的现象有什么相同和不同:
(3)比较反应①与钠和水反应的现象有什么相同和不同: 相同点: ;
相同点: ; 不同点: 。
不同点: 。