某烧碱样品含有少量不与酸作用的杂质,为了测定其纯度,进行以下两步操作: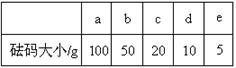
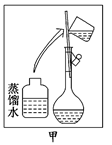
第一步:配制500 ml 烧碱样品溶液。
(1)检查容量瓶是否漏液的方法是:往瓶内加入一定量水,塞好瓶塞。
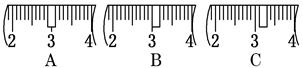
(2)用质量为13.1 g的空烧杯,需要称取烧碱样品20 g。则放在托盘天平上称取时,最终选取所需的砝码为 (填附表中的字母),并在下图中选出能正确表示游码位置的选项 (填字母)。
 |
附表:砝码规格 附:游码位置
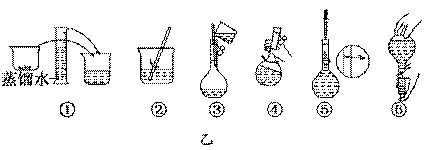
(3) 配制溶液的操作步骤如下图的乙图所示,则甲图操作应在乙图中的 (填选项字母)之间。
A.①与② B. ②与③ C.③与④ D.④与⑤
 |
第二步:中和滴定,以确定烧碱样品的纯度。
A.用碱式滴定管量取25.00 mL烧碱溶液于锥形瓶中,并滴入几滴酚酞作指示剂
B.将浓度为c mol / L的硫酸标准溶液装入润洗好的酸式滴定管中,调节液面使开始读数为V1 mL
C.在锥形瓶下垫一张白纸,滴定至终点时,记下读数为V2 mL
试填空:
(1)滴定至终点的判定标准是:当加入最后一滴硫酸溶液时,溶液的颜色由 色变为 色。
(2)C步骤的操作中,锥形瓶下垫一张白纸的作用是 。
(3)该烧碱样品纯度为_________________________。
有①~⑧八种短周期元素,其原子序数依次增大,其中②、⑦、⑧三种元素在周期表中的相对位置如下,且元素②所处主族的位置为所有主族的正中间。
| ② |
|||
| ⑦ |
⑧ |
(1)元素②在周期表中的位置为周期族;②、⑦、⑧三种元素的原子半径由小到大的顺序是(用元素符号表示)。②、⑦、⑧三种元素最高价氧化物对应水化物的酸性由强到弱的顺序是(用化学式表示)。
(2)如图所示,甲、乙、丙、丁均为①~⑧中某些元素形成的单质或化合物,反应a为置换反应,反应b为化合反应(反应条件已略去),单质乙与单质丙所含元素位于同一主族,任写一个符合条件的反应a的化学方程式:。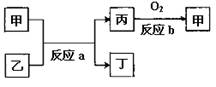
(共9分,每空1分)物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识的回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为
。
(2)B为0.1 mol·L-1NaHCO3溶液,在NaHCO3溶液中存在的各种平衡体系为(用离子方
程式表示):;;
实验测得NaHCO3溶液的pH > 7,请分析NaHCO3溶液显碱性的原因:
。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入,目的是;
若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为
。
(4)D为含有足量AgCl固体的饱和溶液,氯化银在水中存在沉淀溶解平衡:
AgCl(S)  Ag+(aq)+ Cl-(aq) 在25℃时,氯化银的Ksp = 1.8×10-10
Ag+(aq)+ Cl-(aq) 在25℃时,氯化银的Ksp = 1.8×10-10
25℃时,现将足量氯化银分别放入:①100mL蒸馏水中;②100mL 0.2 mol·L-1AgNO3溶液中;③100mL 0.1 mol·L-1氯化铝溶液中;④100mL 0.1 mol·L-1盐酸溶液中。充分搅抖后,相同温度下银离子浓度由大到小的顺序是(填写序号);②中氯离子的浓度为mol·L-1
(共6分,每空2分)一定温度下,向如图所示的带有可移动活塞的密闭容器中充入2 L SO2和1 L O2的混合气体,发生如下反应2 SO2 (g) + O2 (g)  2 SO3(g) 。
2 SO3(g) 。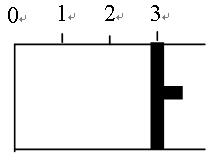
(1)若活塞可自由移动,平衡后,活塞停止在“2.1”处,则该反应中SO2的转化率为________。
(2)若开始时,充入容器的起始物质分别是
①2 L SO2和1 L O2;
②2 L SO3 (g) 和 1 L N2 ;③1 L SO2、1 L O2和 1 L SO3 (g),使活塞固定在“3”处,达到平衡后,容器中SO3 (g)的体积分数大小关系是(用序号和“<”、“=”、“>”表示)。
(3)向(1)平衡后的容器中充入0.2 mol 的SO3,活塞移动后再次达到平衡时,测得此过程中从外界共吸收了1.96 kJ 的热量。写出SO2发生氧化反应的热化学方程式:________。
(共5分,每空1分)测得某溶液的pH = 6.5,且氢离子与氢氧根离子物质的量相等,此溶液呈_____性。测定温度______室温(填高于、低于或等于),其理由是。将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合。
(1)若所得混合液为中性,则a︰b。
(2)若所得混合液的pH=2,则a︰b。
(共6分,每空2分).从H+、Cu2+、Na+、SO42-、Cl-等五种离子中选择适当的离子组成电解质,使之符合下列要求。
(1)以碳棒为电极,电解时电解质质量减小,水量不变,应选用的电解质是________________________________;
(2)以碳棒为电极,电解时电解质质量不变,水量减少,应选用的电解质是________________________________;
(3)以碳棒为阳极,铁棒为阴极,电解时电解质质量和水量都减少,则应选用的电解质是_________________________________。