元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下表所列是五种短周期元素的原子半径及主要化合价(已知铍的原子半径为0.089 nm)。
| 元素代号 |
A |
B |
C |
D |
E |
| 原子半径/nm |
0.16 |
0.143 |
0.102 |
0.099 |
0.074 |
| 主要化合价 |
+2 |
+3 |
+6,-2 |
-1 |
-2 |
(1)用元素代号标出它们在周期表中的对应位置(以下为周期表的一部分)。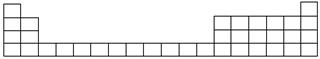
(2)B元素处于周期表中________周期________族。
(3)B的最高价氧化物的水化物与C的最高价氧化物的水化物反应的离子方程式为______________________________________________。
(4)上述五种元素的最高价氧化物对应水化物中酸性最强的是________(填化学式)。
(5)C、E形成的化合物为________(填化学式)。
(6分) 下图是由短周期元素组成的一些单质及其化合物之间的转化关系图。各方框表示有关的一种反应物或生成物(某些物质已经略去),其中A、B、D在常温下均为无色无刺激性气味的气体,C是使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。
⑴物质G的化学式:。
⑵物质B的电子式:。
⑶写出C→E的化学方程式:;
⑷G→F的离子方程式:。
(1)(3分)根据结构对有机物进行分类,有助于对其性质的掌握。
①下列有机物属于芳香烃的是(填字母)。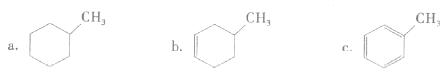
②下列有机物属于酚类的是(填字母)。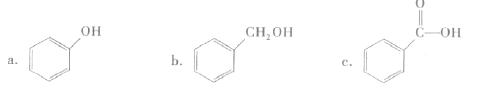
③下列有机物属于糖类的是(填字母)。
a.油脂 b.纤维素 c.蛋白质
(2)(5分)化合物X的结构简式为
①X的核磁共振氢谱图(H核磁共振谱图)上有个吸收峰。
②X的一种同分异构体Y能发生银镜反应,请写出Y的结构简式:。
③X的另一种同分异构体z的结构简式为H2C==CHCH2OH,请写出Z与Br2发生加成反应的化学方程式:。
(3)(7分)2010年上海世博会充分体现了绿色生活理念,节能环保材料在园区内随处可见。如一次性餐盒是由一种生物可降解的高分子合成材料制得.其结构简式如下:
①该高分子材料是由一种单体通过反应(填反应类型)制备而成,其单体的结构简式为。
②若两分子的该单体发生反应,既可能得到环状化合物M,也可能得到链状化合物N。其结构简式如下:
M N
请用两种方法鉴别M和N。方法一:;方法二:。
⑴人体健康与食品、药物等关系密切。
某化学兴趣小组设计以下实验步骤与操作来定性检验茶叶中含有的少量钙、铁、铝三种元素。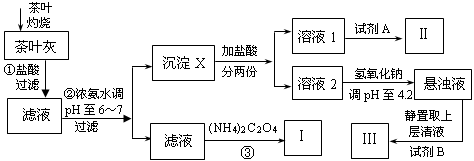
已知Ca2+、Al3+、Fe3+完全形成相应氢氧化物沉淀的pH如下表:
| Ca(OH)2 |
Al(OH)3 |
Fe(OH)3 |
|
| pH |
≥13 |
≥5.2 |
≥4.1 |
(1)步骤①中加入盐酸的作用是。
(2)步骤②中调节pH至6~7的目的是。
(3)沉淀X所含主要物质的化学式为。
(4)写出步骤③中发生反应的离子方程式:。
(5)试剂A为;试剂B为铝试剂,加入该试剂后的实验现象是。
黄血盐(亚铁氰化钾,K4[Fe(CN)6] )易溶于水,广泛用做食盐添加剂(抗结剂),食盐中黄血盐的最大使用量为10 mg·kg-1。黄血盐经长时间火炒,超过400℃时会分解生成剧毒的氰化钾。
回答下列问题:
(1)写出基态Fe2+的核外电子排布式。K4[Fe(CN)6] 中Fe2+与CN-之间的作用力是。
(2)CN-中碳原子的杂化方式为;1molCN-中含有π键的数目为。
(3)金属钾、铁的晶体的晶胞结构如下图,钾、铁两种晶体晶胞中金属原子的配位数之比为。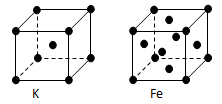
(4)黄血盐溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与CN-是等电子体的气态化合物,反应化学方程式为。