将一定质量Mg、Zn、Al的混合物与足量稀硫酸反应,生成H2 5.6L(标准状况),则原混合物的质量可能是 ( )
| A.2g | B.4g | C.8g | D.18g |
下列关于离子反应的说法中正确的是
A.硫酸亚铁加过氧化氢溶液离子方程式为:Fe2+ + H2O2 + 2H+ Fe3+ + 4H2O Fe3+ + 4H2O |
| B.碘水中通入足量的SO2离子方程式为:I2 +SO2+2H2O=2I-+SO42-+4H+ |
| C.在碳酸氢钠溶液中: K+、Al3+、SO42-、Cl-可大量共存 |
| D.使紫色石蕊试液呈红色的溶液中:Na+、K+、CO32-、NO3-可大量共存 |
设NA为阿伏加德罗常数的值,下列说法正确的是
| A.58 g乙烯和乙烷的混合气体中碳原子数目一定为4NA |
| B.5.6g铁与一定量稀硝酸完全反应,电子转移数目一定为0.3NA |
| C.标准状况下,22.4 L NO与11.2 L O2充分反应后得到的气体分子数为NA |
| D.142g Na2SO4和Na2HPO4固体混合物中,阴阳离子总数为3NA |
下列关于有机物的叙述不正确的是
| A.鉴别甲烷和乙烯,可用酸性高锰酸钾溶液或溴的四氯化碳溶液 |
| B.乙烯分子与苯分子中碳碳键不同,但二者都能发生加成反应 |
| C.油脂是高分子化合物,在空气中完全燃烧生成CO2和H2O |
| D.乙酸乙酯中混有的乙酸杂质可用饱和碳酸钠溶液除去 |
化学在生产和日常生活中有着重要的应用,与环境保护、能源开发利用等方面也密切相关。下列叙述不正确的是
| A.铅笔芯的原材料为铅,儿童使用铅笔时如果用嘴吮咬能够引起铅中毒 |
| B.在有机化工中,氯气是合成塑料、橡胶、农药和人造纤维的重要原料 |
| C.煤炭燃烧过程中安装“固硫”装置,主要是为了减少二氧化硫的排放 |
| D.开发利用可再生能源,可减少化石燃料的使用 |
下列推断正确的是
| A.由C(石墨)=C(金刚石)△H=+1.9 kJ·mol-1,可知石墨比金刚石更稳定 |
B.可逆反应2SO2(g)+O2(g)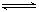 2SO3(g) △H<0,若平衡后再充入一定量氧气,则ΔH增大 2SO3(g) △H<0,若平衡后再充入一定量氧气,则ΔH增大 |
| C.已知CO(g)的燃烧热ΔH=-283.0 kJ·mol-1,则表示CO燃烧热的热化学方程式为2CO(g)+O2(g)===2CO2(g) ΔH=-566.0 kJ/mol |
D.一定条件下,将0.5mol N2(g)和1.5molH2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) 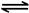 2NH3(g) △H=-38.6kJ·mol-1 2NH3(g) △H=-38.6kJ·mol-1 |