欲配制100ml 1.0 mol/L Na2SO4溶液,正确的方法是.. ( )
① 将14.2 g Na2SO4 溶于100ml水中
② 将32.2g Na2SO4·10H2O溶于少量水中,再用水稀释至100 ml
③ 将20 ml 5.0 mol/L Na2SO4溶液用水稀释至100 ml
| A.①② | B.②③ | C.①③ | D.①②③ |
根据下列反应判断有关物质还原性由强到弱的顺序是( )
①H2SO3+I2+H2O====2HI+H2SO4
②2FeCl3+2HI====2FeCl2+I2+2HCl
③3FeCl2+4HNO3====2FeCl3+NO↑+2H2O+Fe(NO3)3
| A.H2SO3>I->Fe2+>NO | B.I->Fe2+>H2SO3>NO |
| C.Fe2+>I->H2SO3>NO | D.NO>Fe2+>H2SO3>I- |
下列反应需要加入氧化剂才能实现的是…()
| A.Cl2→Cl- | B.H+→H2 | C.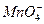 →Mn2+ →Mn2+ |
D.Zn→Zn2+ |
下列说法中正确的是……()
| A.发生化学反应时失去电子越多的金属原子,还原能力越强 |
| B.金属阳离子被还原后,一定得到该元素的单质 |
| C.核外电子总数相同的原子,一定是同种元素的原子 |
| D.能与酸反应的氧化物,一定是碱性氧化物 |
在浓盐酸中,H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2H3AsO3+6H+====2As+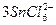 +6M。关于该反应的说法中正确的组合是( )
+6M。关于该反应的说法中正确的组合是( )
①氧化剂是H3AsO3;②还原性:Cl->As;③每生成7.5 g As,还原剂失去的电子为0.3 mol;④M为OH-;⑤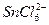 是氧化产物。
是氧化产物。
| A.①②④⑤ | B.①③⑤ |
| C.①②③④ | D.只有①③ |
根据以下实验事实,判断四种微粒在酸性条件下,氧化性由强到弱的顺序是( )
①向FeCl3溶液中滴加KI溶液,再加入CCl4振荡,CCl4层呈紫色;
②向FeCl2溶液中加入氯水,再加入KSCN溶液,呈红色;
③向KMnO4溶液中加入浓盐酸,振荡后紫色褪去。
A.I2>Cl2>Fe3+>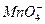 |
B.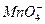 >Cl2>Fe3+>I2 >Cl2>Fe3+>I2 |
C.Cl2>I2>Fe3+>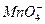 |
D.Fe3+>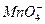 >Cl2>I2 >Cl2>I2 |