反应2A(g)+B(g) 2C(g) ΔH>0。下列反应条件有利于生成C的是( )
2C(g) ΔH>0。下列反应条件有利于生成C的是( )
| A.低温、低压 | B.低温、高压 | C.高温、高压 | D.高温、低压 |
有关下图装置的叙述不正确的是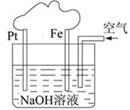
| A.这是电解NaOH溶液的装置 |
B.该装置中Pt为正极,电极反应为:O2+ 2H2O + 4e- 4OH- 4OH- |
| C.该装置中Fe为负极,电极反应为:Fe—2e—=Fe2+ |
| D.溶液中最终产生红褐色沉淀 |
已知反应A2(g)+2B2(g) 2AB2(g)△H <0,下列说法正确的
2AB2(g)△H <0,下列说法正确的
| A.升高温度,正向反应速率增加,逆向反应速率减小 |
| B.升高温度有利于反应速率增加,从而缩短达到平衡的时间 |
| C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动 |
| D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动 |
已知在25℃,101kPa下,l g C8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量。表示上述反应的热化学方程式正确的是
| A.C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(g); △H=-48.40kJ·mol-1 |
| B.C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1);△H=-5518kJ·mol-1 |
| C.C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1);△H=+5518kJ·mol-1 |
| D.C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1);△H=-48.40kJ·mol-1 |
下列说法正确的是
| A.氯碱工业是电解熔融的NaCl,阳极产生Cl2 |
| B.氢氧燃料电池可将热能直接转变为电能 |
| C.氢氧燃料电池工作时氢气在负极被氧化 |
| D.工业上电解熔融的AlCl3来制取铝 |
人造地球卫星用到的一种高能电池――银锌蓄电池,其电池的电极反应式为
Zn + 2OH- - 2e- =" ZnO" + H2↑,Ag2O + H2O + 2e- =" 2Ag+" 2OH-。据此判断氧化银是
| A.负极,并被氧化 | B.正极,并被还原 |
| C.负极,并被还原 | D.正极,并被氧化 |