已知:H2(g) + I2(g) 2HI(g)的平衡常数为K1;1/2 H2(g)+ 1/2 I2(g)
2HI(g)的平衡常数为K1;1/2 H2(g)+ 1/2 I2(g) HI(g)的平衡常数为K2,则K1、K2的关系为( )。
HI(g)的平衡常数为K2,则K1、K2的关系为( )。
| A.K1= 2K2 | B.K1= K22 | C.K1 = K2 | D.2K1= K2 |
S(单斜)和S(正交)是硫的两种同素异形体。
已知:① S(单斜,s)+O2(g) ===SO2(g)△H1=-297.16 kJ·mol-1
② S(正交,s)+O2(g) ===SO2(g)△H2=-296 .83 kJ·mol-1
.83 kJ·mol-1
③ S(单斜,s) ===S(正交,s)△H3
下列说法不正确的是()
A.△H3=—0.33 kJ· mol-1 mol-1 |
| B.单斜硫转化为正交硫的反应是放热反应 |
| C.S(单斜,s)===S(正交,s)△H3<0,正交硫比单斜硫稳定 |
| D.S(单斜,s)===S(正交,s)△H3<0,单斜硫比正交硫稳定 |
充分燃烧一定量的丁烷(C4H10)放出热量为Q,经测定完全吸收它生成的CO2需要消耗5mol/LKOH溶液100ml,恰好生成正盐。则燃烧1mol丁烷放出的热量为 ( )
| A.4Q | B.5Q | C.8Q | D.16Q |
下列热化学方程式正确的是(注: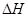 的绝对值均正确)( )
的绝对值均正确)( )
| A.C2H5OH(l)+3O2(g)==2CO2(g) +3H2O(g);△H=" —1367.0" kJ/mol(燃烧热) |
| B.NaOH(aq) + HCl(aq) ="=" NaCl(aq) + H2O(l);△H= —57.3kJ(中和热) |
| C.S(s) + O2(g) ="=" SO2(g);△H= —269.8kJ/mol(反应热) |
| D.2NO2==O2+2NO;△H= +116.2kJ/mol(反应热) |
关于化学反应,下列叙述中不正确的是()
①放热的反应发生时不必加热②化学反应一定有能量变化③吸热反应需要加热后才能发生④化学反应热效应数值(放出或吸收的热量)与参加反应的物质的多少有关
A.①② B.②③ C.①③ D ②④
已知反应:2 E (l)  U (l) 。取等量的E,分别在20℃、50℃测得E的转化率随时间变化的关系曲线(Y-t)如图所示。则下列说法正确的是()
U (l) 。取等量的E,分别在20℃、50℃测得E的转化率随时间变化的关系曲线(Y-t)如图所示。则下列说法正确的是()
| A.该反应的∆H > 0 |
| B.b代表50℃下E的Y-t曲线 |
| C.m点(66,0.113)时有:∆n (E,20℃) = ∆n (E,50℃) |
| D.升高温度可以缩短达到平衡的时间,提高E的转化率 |